摘要:
一名32岁女性因血小板减少、发热、浆膜炎、肝脾肿大、弥漫性淋巴结肿大和肾功能不全入住我院。诊断为系统性红斑狼疮。由于顽固性血小板减少症、浆膜炎和肾功能不全,处方了高剂量甲基强的松龙。除蛋白尿和血尿外,她的尿分析中发现尿酸结晶。发现血清尿酸升高至18 mg/dL。开始输注拉布立酶。在开始拉布立酶治疗并继续高剂量甲基强的松龙治疗的5天内,患者血清肌酐恢复正常,蛋白尿消退。开始拉布立酶治疗后2周内,显微血尿消失,肾功能不全和所有尿液异常迅速逆转,表明肾损伤最可能是由于尿酸介导的肾损伤,而不是狼疮性肾炎。 我们的病例说明了2种不同临床实体的共同发生,一种是患者的年龄、性别和最重要的临床表现,另一种是罕见和意想不到的,但都与肾损伤有关。临床医生必须意识到,需要仔细评估症状和实验室检查,以做出彻底的鉴别诊断,并在最合适的时机提供正确的治疗。
案例展示:
一名32岁女性因顽固性血小板减少症和疑似淋巴瘤转入我院。转诊前3个月,患者开始出现发热、寒战和腹痛。发现她有肝脏和脾脏肿大以及身体多个部位的淋巴结肿大。肿瘤科医生对患者进行了评估,并安排了诊断性实验室检查。然而,在复诊前3天,她因咯血和皮肤易擦伤而在另一家医院住院。观察到贫血、血小板减少和肾功能不全。给予血液制品输注,血小板减少症未改善。然后,她被转诊到我院,推定诊断为淋巴瘤。
入院时,获得了既往炎性关节炎发作史。CBC显示白色细胞计数为6930/μL,血红蛋白为7.1gm/dL,血小板计数为3000/μL,魏氏沉降率(WSR)为150 mm/hr,C反应蛋白(CRP)为188.2mg/dL。血清生化异常:血尿素氮50.2mg/dL、血清肌酐(SCr)2.36mg/dL、钙7.4mg/dL、磷4.9mg/dL、白蛋白1.6gm/dL、碱性磷酸酶246 IU/L和血清尿酸(SUA)18mg/dL。总胆红素和直接/间接胆红素比值正常。尿分析异常,35-40 RBC/HPF,并存在许多尿酸结晶。尿蛋白肌酐比值(SUPCR)为0.815mg/mg。胸部和腹盆区的计算机断层扫描显示双侧胸腔积液、淋巴结病、肝脾肿大和腹水(图1)。
立即根据性别、年龄、浆膜炎、炎性关节炎、肾功能不全和雷诺现象的既往病史,作出系统性红斑狼疮伴多器官受累的临床诊断。认为狼疮性肾炎是肾功能不全的原因,开始静脉(IV)给予甲基强的松龙,每日1 gm,持续3天,随后给予1 mg/kg/天。然而,尿液分析中尿酸结晶的存在和SUA升高使我们怀疑尿酸盐肾病。开始拉布立酶输注。在开始拉布立酶输注后5天内,Scr恢复正常,蛋白尿消退。在拉布立酶输注第2周结束时,显微血尿消退。尿量也从约600 cc/天增加至约1000 cc/天(图2)。
使用皮质类固醇4周后,血小板计数未能增加,开始静脉注射免疫球蛋白(IVIG),每日0.4 gm,持续5天。IVIG输注结束后1个月,患者血小板计数持续低于10000/μL,开始每周IV输注利妥昔单抗750 mg,连续4周。开始利妥昔单抗治疗19天后,血小板计数开始增加,胸腔积液和腹水改善。
之后一年内,患者每天服用泼尼松15 mg和羟氯喹5 mg/Kg/天,没有服用别嘌呤醇。患者血细胞计数正常,Scr为0.78 mg/dL,不存在微量血尿,SUPCR为0.144 mg/mg,SUA为7.6 mg/dL,尿酸排泄分数(FEUA)为6.6%,每小时尿酸(UA)尿排泄量为18.5 mg/1.73 M 2,WSR为27 mm/hr,血清补体水平正常。在随访的一年中,她反复检测抗ds-DNA抗体和狼疮抗凝剂呈阳性,并出现手关节滑膜炎。正电子发射断层扫描显示F-18 FDG在颈部,腋窝,腹膜后和盆腔区域的淋巴结中的亲和力。进行切除颈部淋巴结活检,发现多型淋巴浆细胞浸润。未观察到Storiform纤维化或闭塞性静脉炎。淋巴增生性恶性肿瘤的标记物保持阴性。因此患者不需要进一步的利妥昔单抗输注。
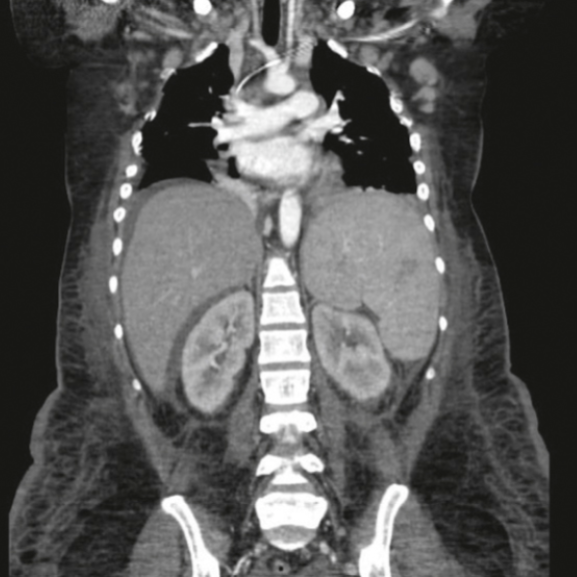
图1:腹盆腔 CT 显示胸腔积液、淋巴结病、肝脾肿大和腹水。

图2:拉布立酶输注期间和输注后的血清肌酐、估计肾小球滤过率(GFR)和血清尿酸。
讨论:
自身免疫性风湿病可能从一开始就涉及多个身体器官的疾病开始。在这种情况下,器官损伤通常被认为是由于自身免疫性疾病。我们的患者符合系统性红斑狼疮(SLE)的明确诊断标准。据报告,美国西班牙裔人群中SLE的患病率约为84.6/100000。据报道,波多黎各人的SLE患病率较高,总体患病率为159/100 000,女性为277/100 000。肾损伤是SLE的常见表现,狼疮性肾炎(LN)的患病率高达50%。LN必须积极治疗,以防止不可逆的肾功能丧失,慢性肾功能不全,并可能需要肾脏替代治疗。
在淋巴结活检中具有淋巴浆细胞浸润和炎性过程的患者中的肾脏疾病的其他潜在原因包括多中心Castleman病(CD)和IgG 4相关疾病。由于患者是HHV-8和HIV-Ab阴性,特发性Castleman病(ICD)及其变异型血小板减少症,全身水肿,腹膜后纤维化,肾功能不全和器官肿大(TAFRO)综合征必须考虑。ICD和TAFRO具有强烈的炎症过程,伴有全身症状,如发热、CRP和WSR升高、器官肿大、多个身体部位的淋巴结病和血细胞减少症。然而,国际诊断标准指出,为了诊断ICD/TAFRO,必须排除SLE等炎性疾病。最近,已发表了初步诊断为明确SLE的病例报告,但随着时间的推移,这些病例报告仅改为ICD/TAFRO。作者将SLE描述为ICD/TAFRO的模拟物。在我们的患者中,长期观察证实了SLE的诊断,因为随着时间的推移,她发展为关节炎,由风湿病学家记录,抗ds-DNA Ab变为阳性,ANA阳性持续存在。尽管淋巴结活检显示淋巴浆细胞浸润,但极不可能发生IgG 4相关疾病(Igg4-rd)。在淋巴结活检中没有故事状纤维化和闭塞性静脉炎并不能排除igg 4-rd,因为这些病理学发现在淋巴结中未见。但igg4-rd通常是中年男性的疾病,临床表现和炎症标志物往往更惰性,她缺乏典型的肾脏放射学CT改变,如肾脏增大和多发结节。此外,患有igg4-rd和肾脏疾病的患者并不少见腹膜后、胰腺、甲状腺或其他器官受累,但在该患者中均不存在。
尿酸肾病的表现为SUA高于15 mg/dL、尿沉渣中存在尿酸结晶、肾功能不全和尿尿酸与肌酐的比值高于1.0。高尿酸血症被认为通过多种机制损伤肾脏,包括尿酸肾内结石形成和阻塞、肾小管细胞炎症和凋亡、肾循环减少和氧化应激增加。在我们的患者中,SUA高于15 mg/dL、尿液中存在尿酸结晶、肾功能不全在开始拉布立酶治疗后5天内恢复至正常SCr,同时尿量增加,以及微量血尿快速消退提示尿酸肾病。由于持续性血小板减少症,最初未进行肾活检以记录LN的存在。后来,在患者的临床病程中,由于SCr水平和尿沉渣正常,以及作者从未见过中度肾功能不全的LN患者在开始皮质类固醇治疗后14天内达到完全肾缓解,因此未考虑。考虑进行肾活检以进行尿酸盐肾病的组织诊断。然而,考虑到患者的风险与受益比,我们决定不推荐活检。肾活检可能未显示尿酸晶体,因为当血小板计数稳定且活检可以以更安全的方式进行时,患者已完成所有拉布立酶输注并正在接受别嘌呤醇治疗。此外,即使活检显示肾小管中存在尿酸盐沉积,也认为改变治疗的可能性很小。
入院时SUA升高的原因尚不清楚。不存在与SUA突然升高相关的疾病,如肿瘤溶解综合征、横纹肌溶解和反复癫痫发作。也未发现与SUA逐渐增加相关的疾病。血清尿酸升高的遗传原因是极不可能的,因为她有一个大家族,有许多一级和二级亲属,并且有痛风或尿酸结石的阴性家族史。出院一年后,患者停用别嘌呤醇后SUA仍轻微升高。FEUA正常,表明SUA升高不是由尿酸过度产生引起的。患者可能在入院前数周发生SUA水平升高,推测是由于活动性组织坏死导致尿酸肾清除率升高和尿酸肾病。
总之,我们报告了一例肾功能不全的女性患者,同时发生了2种不同的导致肾损伤的临床疾病。SLE,一种在40岁以下的女性中并不罕见的疾病,其通过自身免疫机制引起肾损伤,以及尿酸盐肾病,一种极其罕见的肾损伤原因,在缺乏严重高尿酸血症的可识别原因的年轻女性中可观察到,其通过肾组织中的尿酸沉积和免疫介导的机制引起肾损伤。由于没有证据表明尿酸结石会物理性阻碍尿流,因此,单独使用甲基强的松龙输注(专门用于LN)最有可能通过其抗炎作用控制尿酸盐肾病。在这方面,类固醇单独治疗两种不同的致病原因的肾损伤,共享相似的损伤机制。然而,甲基强的松龙和拉布立酶联合输注最有可能加速尿酸盐肾病的控制,降低长期肾损伤的可能性。
临床医生不能忘记,进行鉴别诊断对于得出正确的诊断和提供适当的治疗是必要的,以防止不必要的并发症,特别是因为不同的临床实体并不总是对相同的治疗有反应。
参考文献:
【1】T. Dörner and R. Furie, “Novel paradigms in systemic lupus erythematosus,” Lancet, vol. 393, no. 10188, pp. 2344–2358, 2019.
【2】K. J. John, M. Sadiq, T. George et al., “Clinical and immunological profile of mixed connective tissue disease and a comparison of four diagnostic criteria,” International Journal of Rheumatology, vol. 2020, Article ID 9692030, 6 pages, 2020.
【3】M. Petri, A. M. Orbai, G. S. Alarcón et al., “Derivation and validation of the systemic lupus international collaborating clinics classification criteria for systemic lupus erythematosus,” Arthritis & Rheumatism, vol. 64, no. 8, pp. 2677–2686, 2012.
【4】M. Aringer, K. Costenbader, D. Daikh et al., “2019 European league against rheumatism/american college of rheumatology classification criteria for systemic lupus erythematosus,” Annals of the Rheumatic Diseases, vol. 78, no. 9, pp. 1151–1159, 2019.
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请及时通过电话(400-626-9910)或邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。