自2010年III期临床试验首次证实依匹木单抗(ipilimumab)可改善恶性黑色素瘤患者总生存率,免疫检查点抑制剂(immune checkpoint inhibitors, ICI)在肿瘤免疫治疗领域不断取得进展,深刻变革了肿瘤治疗理念,将治疗靶点由肿瘤转向自身免疫系统,2018年荣获诺贝尔生理学医学奖。ICI通过抑制免疫检查点(如细胞毒性淋巴细胞相关抗原4(cytotoxic T-lymphocyte antigen 4, CTLA-4)、程序性细胞死亡蛋白-1(programmed cell death protein 1, PD-1)及程序性细胞死亡蛋白配体-1(programmed cell death ligand 1, PD-L1)等),阻断肿瘤免疫逃逸机制,促进机体对肿瘤的免疫应答,改善肿瘤患者生存,但伴随而来的是对全身其他脏器产生的免疫相关不良反应(immune-related adverse events, irAE),心脏毒性是其中少见但严重的irAE。ICI相关心脏毒性初期多为零星的个案报道,近年来随着ICI临床应用的开展及适应症的扩大,相关病例不断增多,ICI相关心脏毒性逐渐成为热点,出现样本量增多的病例系列、回顾性分析 、注册登记研究及meta分析等,但目前对其机制及管理等方面的理解仍十分有限。既往ICI在中国尚处于临床试验阶段,已观察到部分出现心脏毒性的患者,近期ICI在中国逐步上市,预计ICI相关心脏毒性的病例将不断增多,提高临床医生对其的认识十分必要。在此根据现有证据,对ICI相关心脏毒性的临床表现、机制、诊断、治疗及预后等做一综述。
免疫检查点抑制剂的应用进展
免疫调节点(如CTLA-4、PD-1等)是机体抑制T细胞过度活化,阻断自身免疫应答失控的重要机制。肿瘤抗原经抗原递呈细胞(antigen presenting cells, APC)递呈后,通过主要组织相容复合物(major histocompatibility complex, MHC)与T细胞受体(T cell receptor, TCR)结合,激活纯真T细胞,T细胞表面的CD28与APC表面的CD80(B7-1)或CD86(B7-2)结合对此过程起协同作用,而T细胞表达的CTLA-4可与CD28竞争性结合CD80/CD86,阻止T细胞激活并使之失能,同时CTLA-4可增强调节性Treg细胞的活性,起到免疫抑制作用。肿瘤细胞还可表达PD-L1,通过与效应T细胞表面的PD-1结合使其失活并凋亡,导致免疫逃逸。免疫调节点抑制剂通过阻断CTLA-4、PD-1、PD-L1等免疫下调机制位点,激活自身免疫系统对肿瘤细胞的应答,起到抗肿瘤作用。目前已有数个ICI (如CTLA-4抑制剂: iplimumab;PD-1抑制剂: pembrolizumab,nivolumab;PD-L1抑制剂: atezolizumab , avelumab,durvalumab)经美国食品药品管理局批准并上市,获准用于多种不同肿瘤(如非小细胞肺癌、肾细胞癌、淋巴瘤、头颈部肿瘤等),临床研究证实其有效性,可改善多种肿瘤患者的总生存率,其中nivolumab和pembrolizumab已于2018年在中国上市。ICI在激活免疫系统起抗肿瘤作用的同时,可能产生脱靶效应,引起irAE,其机制尚不完全明确,推测与其打破机体自身免疫与免疫耐受之间的平衡有关。ICI相关不良反应十分常见,全身各个脏器均可受累,常见的有皮疹、结肠炎、肝炎、甲状腺炎等,少见但严重的irAE包括肺炎、肾损伤、心脏毒性、神经系统毒性等,根据Common Terminology Criteria for Adverse Events (CTCAE)标准,大部分不良反应为1-2级,患者对其耐受性通常良好。免疫相关心脏毒性在irAE中发生率低但进展迅速,死亡率高,需引起重视。
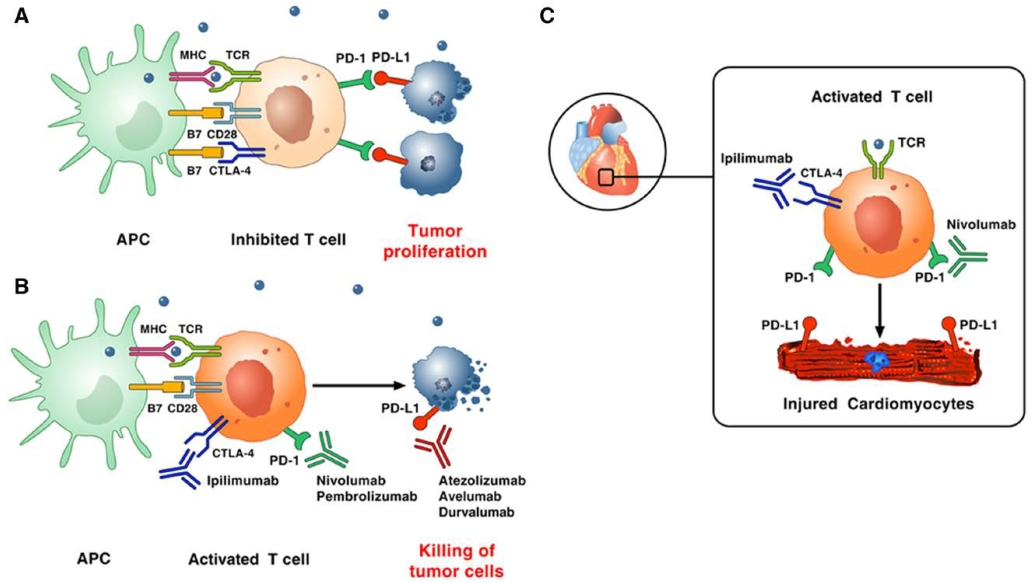
图源(Varricchi G, Galdiero MR, Tocchetti CG: Cardiac Toxicity of Immune Checkpoint Inhibitors: Cardio-Oncology Meets Immunology. Circulation 2017, 136(21):1989-1992.DOI:10.1161/circulationaha.117.029626)
免疫检查点抑制剂心脏毒性
1 发生率
对百时美施贵宝公司截至2016年4月的药物安全性数据库进行分析显示,0.09%接受ICI治疗的患者出现心肌炎,其中接受ICI联合治疗的患者发生心肌炎的比例更高(0.27%),诊断中位时间是接受首次ICI治疗后17天。但在一项8个临床中心的注册登记研究中,1.14%接受ICI治疗患者发生心肌炎,发病中位时间是首次治疗后34天。由于既往ICI应用过程中心脏相关实验室指标监测及影像学检查并非常规,实际发病率可能更高。大部分ICI相关心脏毒性发生于首次治疗后2-3月内,但也有迟发性起病的报道。ICI相关心脏毒性发生的危险因素尚不十分明确,可能相关的因素包括合并自身免疫性疾病、基础心脏疾病、糖尿病,联合用药等。
2 临床表现
2.1 心肌炎:心肌炎是ICI相关心脏毒性中最常被报道的,临床表现以充血性心力衰竭、心律失常等相关症状为主,异质性较大且不特异,胸闷、气短、乏力等是常见的主诉,也可以恶心等不典型症状起病,部分患者可无症状,仅表现为心脏标志物升高,而部分严重患者可表现为暴发性心力衰竭,甚至快速进展的心源性休克。大部分ICI相关心肌炎患者有心肌肌钙蛋白(cardiac troponin, cTn)的升高,心电图及超声心动图异常亦很常见,患者的射血分数可正常或出现不同程度的减低。许多患者在发生ICI相关心肌炎的同时合并其他irAEs,其中最常见的是肌炎,约有1/4的患者合并肌炎。
2.2 心律失常:心律失常是ICI相关心脏毒性的另一重要表现,可与左心收缩功能障碍合并或单独出现,患者可发生房颤、室上性或室性心动过速等各种心律失常,传导阻滞十分常见,且常常进展至完全性传导阻滞,甚至发生心脏骤停,尸检可见淋巴细胞浸润窦房结及房室结。
2.3 其他:ICI治疗相关心包炎、心包积液、心包填塞等已多次被报道,可出现于治疗开始后的10至50周,对心包积液相关病因(如感染性、肿瘤性等)筛查未见明显阳性结果。ICI相关心包炎发生机制尚不明确,考虑可能与细胞毒性T细胞浸润心包相关,患者在糖皮质激素辅以心包引流等治疗后好转。ICI还被报道可引起高血压、症状性窦性心动过速、心绞痛、Takotusbo样心肌病等。
3 机制
ICI相关心脏毒性的确切机制尚不十分明确。基础研究表明心肌抗原激活T淋巴细胞在自身免疫性心肌炎的发生中起重要作用。免疫检查点CTLA-4、PD-1等参与建立针对活化T细胞的外周免疫耐受机制,在动物试验中,CTLA-4、PD-1与PD-L1有助于保护心肌免受免疫相关损伤。Love等报道CTLA-4可限制细胞毒性T细胞增殖,阻断心肌炎病理生理机制,CTLA-4缺陷的CD8+细胞毒性T淋巴细胞较野生型细胞毒性T细胞更易导致致命性心肌炎。Nishimura和Okazaki等的研究显示PD-1基因敲除小鼠可出现抗肌钙蛋白抗体介导的扩张性心肌病。PD-1缺陷的自身免疫疾病模型小鼠可出现淋巴细胞性心肌炎,在PD-L1缺陷小鼠中亦观察到类似的致死性淋巴细胞性心肌炎。CTLA-4抑制剂通过与CD80/CD86竞争性结合CTLA-4,PD-1抑制剂与PD-L1抑制剂通过阻断PD-1与其配体PD-L1的结合,破坏外周免疫耐受,使T细胞的激活易化,导致心脏损害。此外,对ICI相关心肌炎患者的尸检显示心肌、骨骼肌及肿瘤组织可见大量T细胞浸润,对浸润淋巴细胞TCR的测序发现三者存在高度克隆扩增,同时肿瘤组织中检出肌肉特异性抗原,提示心肌与肿瘤组织表达相同抗原可能是ICI相关心脏毒性的机制之一。
4 诊断
ICI相关心脏毒性起病急骤,致死率高,需要临床医生提高警惕、及时识别。初始评估包括详细的病史询问及体格检查,应迅速地对患者的心功能、血流动力学稳定性、电生理异常等情况进行综合评估,注意有无危及生命的紧急情况。心电图及cTn检查是初步检查的重要手段。心电图异常在ICI相关心脏毒性中十分常见,包括ST-T变化、束支阻滞、快速/缓慢心律失常等,灵敏度及特异度有限,但其在识别完全性传导阻滞、室性心动过速等心律失常中的作用毋庸置疑,必要时还可行动态心电图或持续心电监测。心脏标志物(如cTn、肌酸激酶等)对心脏损伤有重要诊断意义。大部分已报道的暴发性心肌炎患者存在cTn升高,但cTn正常不能完全除外ICI相关心脏毒性,特别是在ICI治疗晚期起病者。其他指标如脑利钠肽(brain natriuretic peptide, BNP)、N端-脑利钠肽前体(N-terminal pro brain natriuretic peptide, NT-proBNP)、血沉、C反应蛋白、自身免疫抗体等亦有助于辅助诊断。指南建议在ICI治疗前留取基线心电图及心脏标志物检查,并在治疗过程中定期监测,出现症状时及时复查。
对于怀疑ICI相关心脏损害的患者下一步可行超声心动图或心脏核磁共振(cardiac magnetic resonance imaging, CMR)检查。典型的心肌炎发生时可出现室壁增厚、心室收缩功能减低、弥漫性或局限性室壁运动减低等,但多随病情演进而呈动态变化,建议反复行超声心动图检查。CMR空间分辨率高,可对心肌组织特征进行无创评估,心肌炎症浸润时毛细血管渗透性增加,可出现组织水肿及细胞坏死,CMR检查可出现钆造影剂延迟强化等表现,能为诊断提供更多信息。但CMR亦存在局限性,如检查时间过长、正在接受呼吸循环支持或起搏器治疗的重症患者无法进行检查等。
根据Dallas标准,心内膜活检仍是ICI相关心肌炎诊断的金标准。但由于其有创性、风险性及活检范围局限性等缺点,心内膜活检目前仍未常规普及,是否行心内膜活检应由心内科医生、肿瘤科医生、患者及家属等共同讨论,综合考虑患者病情及预后、活检相关获益与风险(如心肌穿孔、心律失常、心包填塞等)后决定。ICI相关心脏毒性患者心内膜活检病理可见心肌组织淋巴细胞浸润伴或不伴纤维化,可累及窦房结、房室结等,免疫组化染色可见CD4+及CD8+ T细胞、CD68+巨噬细胞等,同时可见FOXP3+ Treg细胞减少,CD20-有助于除外抗体介导免疫反应。
怀疑ICI相关心脏损害的同时需进行充分的鉴别诊断,注意除外其他病因导致的心脏损害,冠脉造影、冠脉CTA等有助于除外缺血性心脏病,病毒相关血清学检查、心内膜活检组织PCR扩增等有助于排除病毒性心肌炎。肿瘤患者多存在合并用药,需充分考虑其他可能导致心脏毒性的药物。
对于发生ICI相关心脏毒性的患者,为评估病情及指导治疗,应根据CTCAE标准进行分级:1级:无症状,但心脏标志物检查(如cTn、BNP)异常或心电图异常;2级:中等活动出现症状,伴实验室检查异常;3级:休息或轻微活动时出现症状,需要干预;4级:危及生命,需要紧急干预(如持续静脉治疗、机械循环支持)。
5 治疗
ICI相关心脏损害常进展迅速,一旦诊断需尽快启动治疗。目前关于ICI相关心脏毒性治疗的前瞻性研究很少,癌症免疫治疗协会(Society for Immunotherapy of Cancer, SITC)、欧洲肿瘤内科学会(European Society for Medical Oncology, ESMO)、美国临床肿瘤学会(American Society of Clinical Oncology, ASCO)、国立综合癌症网络(National Comprehensive Cancer Network, NCCN)等根据现有经验及有限证据,在指南中对ICI相关心脏毒性的处理作出了相应推荐,对临床实践具有一定指导意义。停止ICI治疗及免疫抑制治疗目前仍是ICI相关心脏损害治疗的基石,糖皮质激素是免疫抑制治疗中的一线药物,尽早开始大剂量激素治疗可改善ICI相关心脏损害患者左室收缩功能,减少主要心血管不良事件(major adverse cardiac events, MACE)。关于糖皮质激素的用量,对于ICI相关心肌炎,推荐初始尽快予大剂量(1-2mg/kg)强的松或甲强龙(根据病情决定静脉或口服给药),对于病情严重(3-4级)或大剂量激素治疗3-5天后反应欠佳的患者,可考虑激素冲击治疗(甲强龙1g静脉输注3-5天)。患者病情稳定、心功能恢复至基线水平后可考虑开始减量,在4-6周内逐渐减停。对重症心肌炎、糖皮质激素治疗无效或不耐受的患者,可考虑加用他克莫司、吗替麦考霉酚酸酯、英夫利昔单抗、抗胸腺细胞球蛋白、血浆置换等其他免疫调节治疗。需要注意的是,英夫利昔单抗曾被观察到可能导致心衰的发生及恶化,其应用存在争议。
在免疫抑制治疗的同时,支持治疗亦十分重要,建议取得心内科医生的协助。充血性心衰患者应适当利尿,并在可耐受的情况下逐步加用β受体阻滞剂、RAAS阻滞剂等心血管指南推荐的治疗,心包积液患者可适当行心包引流,发生心律失常的患者需根据情况予抗心律失常治疗,对于出现心脏传导阻滞的患者,进展至完全性传导阻滞的比例较高,应适当放宽起搏器植入指征。部分患者病情呈暴发性进展,迅速出现心源性休克及多脏器功能衰竭,最终导致死亡,对于血流动力学不稳定患者应尽早予有创血流动力学监测并加强循环支持治疗。
发生ICI相关心脏损害的患者通常不建议再次尝试ICI治疗,ASCO指南建议所有发生ICI相关心脏毒性的患者终身禁用ICI,而NCCN指南中对于发生1级心脏毒性的患者,症状好转后可考虑再次尝试ICI治疗。对于许多晚期肿瘤患者而言,ICI可能是唯一可行治疗,是否重启及何时重启ICI治疗需根据肿瘤病情、ICI治疗反应性、备选疗法、心脏毒性严重程度、对免疫抑制治疗的反应性、患者意愿等进行个体化考量,由肿瘤科医生、心内科医生及患者共同讨论决定。对于决定重启治疗的患者,可考虑换用其他类型的单个ICI治疗并进行严密监测。
6 预后
目前关于ICI相关心脏毒性的报道多为个案报道及小规模回顾性研究,偏倚较大,对其预后的认识有限。世界卫生组织个人病例安全数据库分析显示,101名ICI治疗后发生心肌炎的患者中有46例(46%)死亡,接受PD-1或PD-L1抑制剂联合CTLA-4抑制剂治疗者死亡率高于PD-1或PD-L1抑制剂单药治疗者(67% vs 36%, p=0.008),5位接受ipilimumab单药治疗的患者中亦有3位(60%)死亡。现有报道显示ICI相关心肌炎较其他病因所致心肌炎预后更差,Mahmood等还发现cTn升高、糖皮质激素用量低等与预后不良相关。未来的大规模、前瞻性的随访研究将有助于进一步明确ICI相关心脏损害患者的长期预后。
讨论
ICI的出现是肿瘤免疫治疗领域的重要里程碑,可明显抑制肿瘤增殖,改善患者生存,在实体及血液系统肿瘤中均取得良好疗效,为肿瘤患者提供更多治疗选择,但伴随而来的是irAE的发生。心脏毒性是ICI应用中少见但严重的不良反应,具有发病早、症状不特异、进展迅速、致死率高等特点,需引起临床医生的重视。既往在ICI临床试验及治疗过程中未常规进行心脏相关评估,对ICI相关心脏毒性发病率可能存在低估,未来更大样本量、更长随访时间的注册研究将有助于明确心脏毒性的真实发生率。ICI相关心脏毒性的发生机制目前尚不完全明确,应积极对其毒理学、免疫学、分子生物学等机制进行探索,进一步阐明心脏毒性相关特点与危险因素。随着ICI在中国的逐步上市,同时多种新型ICI正在研发中,临床医生必须提高对ICI相关心脏毒性的认识与警惕,在ICI应用前及使用过程中应定期进行心血管评估,以便早期识别ICI相关心脏毒性并及时治疗。ICI相关心脏毒性发生率低,开展大规模前瞻性研究难度大,应充分调动各医疗中心之间的资源,加强合作,共同开展针对ICI相关心脏毒性的高质量研究,为优化监测及治疗方案提供更多证据。随着肿瘤研究领域日新月异的进展,肿瘤治疗手段逐步增多,患者生存时间明显延长,合并心脏疾病的比例逐渐升高,同时多种肿瘤治疗方法可导致心血管并发症,肿瘤心脏病学的理念应运而生并逐渐引起重视,ICI相关心脏毒性正是肿瘤学、心脏病学等多学科交叉的重要案例,应建立由肿瘤科医生、心内科医生、免疫科医生、全科医生、检验科医生、影像科医生、病理科医生等共同组成的协作团队,在治疗前病情评估、肿瘤治疗计划制定、治疗过程中心脏毒性监测与处理等方面共同努力,使患者在肿瘤得到控制的同时优化心血管健康,获得高生活质量的长期生存。
参考文献
[1] Spain L, Diem S, Larkin J. Management of toxicities of immune checkpoint inhibitors[J]. Cancer Treat Rev, 2016, 44: 51-60. PMID: 26874776. doi: 10.1016/j.ctrv.2016.02.001.
[2] Brahmer JR, Lacchetti C, Schneider BJ, et al. Management of Immune-Related Adverse Events in Patients Treated With Immune Checkpoint Inhibitor Therapy: American Society of Clinical Oncology Clinical Practice Guideline[J]. J Clin Oncol, 2018, 36(17): 1714-1768. PMID: 29442540. doi: 10.1200/JOP.
[3] Thompson JA. New NCCN Guidelines: Recognition and Management of Immunotherapy-Related Toxicity[J]. J Natl Compr Canc Netw, 2018, 16(5S): 594-596. PMID: 29784734. doi: 10.6004/jnccn.2018.0047.
[4] Haanen J, Carbonnel F, Robert C, et al. Management of toxicities from immunotherapy: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2017, 28(suppl_4): iv119-iv142. PMID: 28881921. doi: 10.1093/annonc/mdx225.
[5] Puzanov I, Diab A, Abdallah K, et al. Managing toxicities associated with immune checkpoint inhibitors: consensus recommendations from the Society for Immunotherapy of Cancer (SITC) Toxicity Management Working Group[J]. J Immunother Cancer, 2017, 5(1): 95. PMID: 29162153. doi: 10.1186/s40425-017-0300-z. ADDIN EN.REFLIST
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请及时通过电话(400-626-9910)或邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。