介绍
抗肾小球基底膜病是由抗GBM自身抗体引起,通常表现为坏死性和新月体性肾小球肾炎,常导致肺出血。抗GBM病是一种抗GBM免疫球蛋白G (IgG)自身抗体在脏器中线性沉积所引起的罕见的自身免疫疾病,其自身抗体最常见的靶标是α 3链非胶原区(α3NC1)结构域。典型的抗GBM病常表现为快速进展性肾小球肾炎伴肺出血,患者预期寿命缩短,肾预后不良。然而有一类患者虽然免疫荧光呈IgG线性强染色,但其肾脏预后比典型抗GBM患者更好,症状也更轻。此外,这类患者缺乏对抗IV型胶原α3NC1的循环抗体。该类临床表现被称为非典型抗-GBM病。非典型抗GBM疾病可能是由血液循环中致病性免疫球蛋白识别不同的GBM靶标而不是典型的抗GBM自身抗体靶标引起的。典型的抗GBM病往往比其他类型的肾小球肾炎恶化更快。因此,早期诊断和积极治疗非常重要。典型的抗GBM病患者通常接受大剂量糖皮质激素、免疫抑制剂如环磷酰胺和血浆置换治疗。对非典型抗GBM的治疗就有些争议,目前尚不清楚积极治疗收获的益处是否大于风险。
本文报告一例肾活检未见新月体肾小球肾炎及循环中α3NC1抗体阴性的伴蛋白尿、血尿急性肾损伤的患者。本文使用间接免疫荧光方法来诊断抗GBM疾病。在接受大剂量糖皮质激素和血浆置换的积极治疗后,患者的蛋白尿和血尿消失,肾功能得到改善。包括。
案例展示
患者43岁女性,因反复血尿1月+来我院就诊。1月前患者出现血尿,于家周围医院就诊,考虑尿路感染,口服抗生素治疗,但后反复出现血尿。行膀胱镜检查未见异常。患者既往无肾功能不全病史。入院后初次尿液分析示尿蛋白肌酸比:1.24g/gCr,尿红细胞:>300/高镜视野,红细胞管型。血生化全套示进行性肾功能不全。(表1)
表1 患者入院时和治疗最后一天的尿、血液检查结果。


入院时,血压:146/94 mmHg;其余体格检查未见异常。尿液分析:潜血3+,尿蛋白1+,尿蛋白肌酐比1.42g /gCr。尿红细胞数200-299 /高倍镜视野。血清尿素氮13.8 mg/dL,血清肌酐1.44 mg/dL,eGFR为33mL/min/1.73m2。
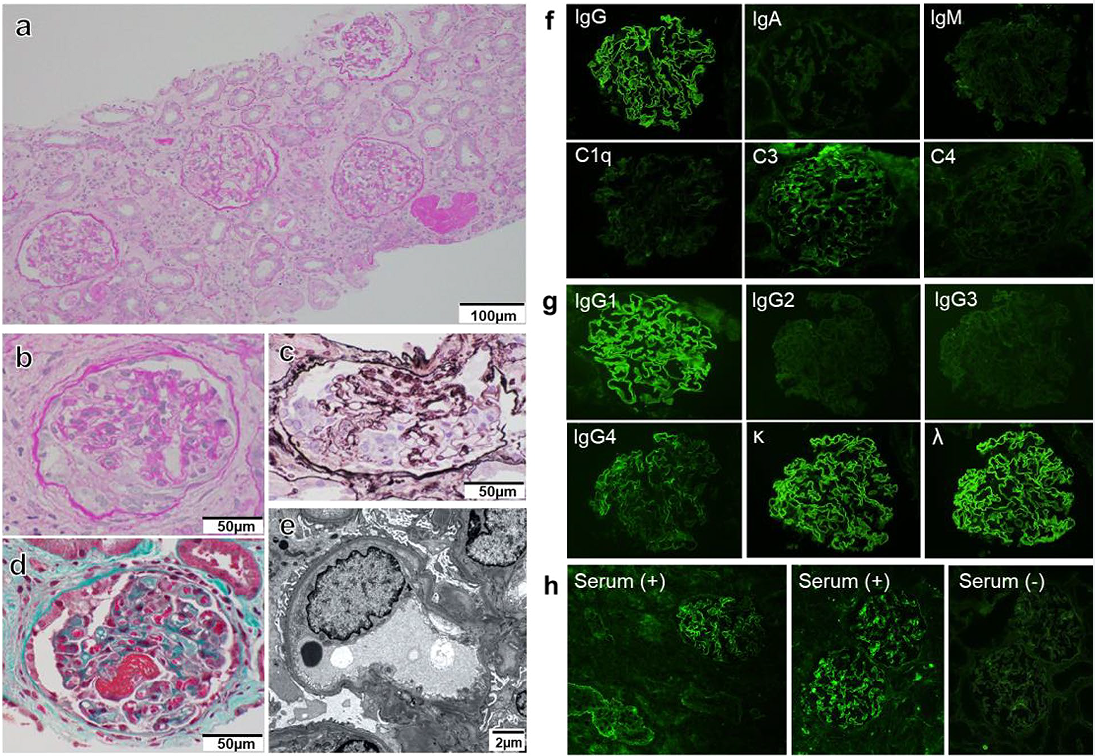
血清学检查示肝炎病毒阴性,补体水平正常(C3: 135 mg/dL, C4: 36 mg/dL),自身抗体(抗核、抗中性粒细胞胞浆和抗GBM抗体)阴性。腹部超声示肾脏大小正常。光镜下,各层可见30个肾小球,无肾小球硬化(图1a)。3个肾小球可见细胞新月体,其他肾小球未见纤维新月体(图1b-d)。除新月体肾小球肾炎,可见5个肾小球毛细血管内细胞增生。血管壁无双轨征,无透明血栓。电镜示,可见部分基底膜侧上皮细胞足突消失(图1e)。
免疫荧光示弥漫性线性强染色IgG。对IgG亚型进行免疫荧光染色:IgG1、IgG4阳性;以IgG1(3+)染色为主,IgG4(1+)染色强度较弱。IgG2、IgG3染色均为阴性。肾小球毛细血管C3(1+)阳性。免疫荧光染色游离kappa链和lambda链均为阳性(图1f和g)。
因为荧光酶免疫分析没有检测到抗GBM抗体,我们额外使用异硫氰酸荧光素标记的抗人IgG进行间接免疫荧光分析,将患者血清应用于正常肾组织,来确定IgG是否与GBM结合(图1h),结果检测到了抗GBM抗体。
图1 a 光镜下可见30个肾小球,无肾小球硬化。b-d 3个肾小球可见细胞新月体,其他肾小球未见纤维新月体。e 电镜示部分基底膜侧上皮细胞足突消失。f和g 免疫荧光染色游离kappa链和lambda链均为阳性。h 使用异硫氰酸荧光素标记的抗人IgG的间接免疫荧光结果
患者接受大剂量糖皮质激素、环磷酰胺和血浆置换治疗。因为患者发生贫血,停用环磷酰胺。在进行三次糖皮质激素冲击治疗和血浆置换的积极治疗,患者蛋白尿和血尿减少,肾功能得到改善。治疗结束时,蛋白尿和血尿缓解,肾功能进一步改善(表1)。
讨论
本文报告了一例表现为蛋白尿,血尿和急性肾损伤的非典型抗GBM病患者。病理检查肾组织中可见新月体肾小球肾炎。因为荧光酶免疫分析没有检测到结合α3 (IV型胶原) NC1的抗GBM抗体,所以我们采用异硫氰酸荧光素标记的抗人IgG间接免疫荧光来鉴定抗GBM抗体。高剂量糖皮质激素和血浆置换联合治疗对伴有急性肾损伤的非典型抗GBM疾病有效,可改善蛋白尿、血尿和肾功能损害。
抗GBM病组织学上常表现为新月体性坏死性肾小球肾炎,以抗GBM IgG线性沉积和抗GBM抗体血清学阳性为特征。在1967年由Lerner等人首次报道。
典型的抗GBM病常表现为快速进展性肾小球肾炎伴肺出血,导致预期寿命缩短,肾预后差。与典型的抗GBM病相比,非典型抗GBM病表现为更轻的症状和更好的肾脏预后,而且在非典型抗GBM病患者中未检测到血液循环中α3NC1抗体。
抗GBM病的病理特征是GBM中IgG线性沉积,伴有抗GBM的自身抗体阳性。抗GBM抗体识别IV型胶原α3链NC1结构域n端17-31 (EA)和c端127-141 (EB)的氨基酸残基作为抗原表位。
抗GBM抗体可采用间接免疫荧光法、Western blot法、酶免疫分析法法(包括ELISA、CLEIA、FEIA)检测。使用全自动的分析方法可以快速获得EIA结果。该方法具有较高的敏感性和特异性。然而在某些情况下,酶免疫分析法无法检测到抗GBM抗体;因此,使用间接免疫荧光或其他方法识别抗GBM抗体的存在很重要。
我们推测可能有以下几个原因导致酶免疫分析法无法检测到抗GBM抗体。第一,抗GBM抗体的滴度太低。在一些文献报告中,低滴度的循环抗GBM抗体与轻度蛋白尿、血尿和肾功能损害有关。抗体对α3NC1肽的亲和力低也会导致新月体肾小球肾炎减少和更好的预后。低亲和力的抗体只能通过敏感的试验方法来检测,如Western blot,而不能通过常规方法。第二,一些患者的自身抗体的靶抗原可能是除α3NC1外的GBM上的抗原。因此,常规检测无法检测到抗体。本病例采用了间接免疫荧光来检测血清抗GBM抗体。第三,循环抗体被肝脏破坏的速度大于抗体分泌的速度。在此情况下,抗体只存在于GBM中,很少或没有抗体留在血液循环中,也就很难被检测出了。
经典的抗GBM病患者,特别是初始血肌酐水平低于5mg /dL和/或肺出血的患者,通常接受大剂量糖皮质激素、环磷酰胺和血浆置换治疗。然而,对于临床和病理轻度异常且无肺出血的非典型抗GBM患者,尚不清楚这些积极治疗的益处是否大于风险。本例患者无肺出血,但肾功能下降,因此予大剂量类糖皮质激素和血浆置换积极治疗,以消除蛋白尿和血尿和改善肾功能。当然,最佳的治疗方法还需要进一步的研究。
总之,我们报告了一例非典型抗gbm患者。如果ELISA、CLEIA或FEIA等酶免疫分析法无法检测到抗GBM抗体,使用间接免疫荧光或其他方法来诊断抗GBM病有助于及时尽早开始治疗。
本站所注明来源为"爱爱医"的文章,版权归作者与本站共同所有,非经授权不得转载。
本站所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请及时通过电话(400-626-9910)或邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。