抗胸腺基质淋巴细胞生成素治疗在2型炎症通路相关疾病的应用及展望
+关注
【摘要】胸腺基质淋巴细胞生成素(TSLP)是IL-7家族成员,有两种亚型,长亚型(lfTSLP)作用于2型炎症通路上游,参与过敏性疾病级联反应,短亚型(sfTSLP)则起到维持稳态作用。长短两亚型还在炎症性肠病、肿瘤等疾病中发挥不同作用。TSLP单克隆抗体特泽鲁单抗被FDA批准用于中重度药物控制不良哮喘患者的附加治疗,临床试验证明特泽鲁单抗不仅针对2型炎症型哮喘,对其他表型的哮喘也有效,且有望应用于其他2型炎症相关疾病,如特应性皮炎的治疗。抗TSLP疗法在其他疾病的应用也正在开发中。目前大多数针对TSLP的药物研究并未区分lfTSLP和sfTSLP,理想状态下,用于中和TSLP的单克隆抗体不应相互作用或阻碍sfTSLP的稳态作用。此外,TSLP的不同亚型在肿瘤和自身免疫性疾病中的作用及机制尚存在争议。目前仍需要更多研究阐明TSLP对免疫系统的影响,并探讨如何拓宽抗TSLP临床应用和抗TSLP治疗潜在的不良反应。
【关键词】特泽鲁单抗;2型炎症;哮喘;胸腺基质淋巴细胞生成素
近年来,2型免疫反应逐步从“树突细胞(dendritic cell,DC)-2型T辅助细胞(Th2)轴”拓展为“2型固有淋巴样细胞(type 2 innate lymphoid cell,ILC2)-DC-Th2轴”,而2型免疫的失衡将导致2型炎症,引起哮喘、过敏性鼻炎、特应性皮炎等疾病[1]。针对2型炎症通路的干预措施可成为这类疾病的治疗靶点,以有效防治相关疾病。目前,局部或全身用激素控制不良的2型炎症相关疾病可以考虑生物制剂疗法,但现有生物制剂多针对2型炎症下游细胞因子,如IgE、白细胞介素(interleukin,IL)-4R、IL-5等,不能完全涵盖2型炎症通路,部分患者对这些药物的应答欠佳。因此,需要开发更有效的治疗策略管理2型炎症相关型疾病。
胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP)是一种上皮细胞衍生细胞因子,最初于1994年在鼠胸腺基质细胞系的上清液中被发现。2001年有研究发现TSLP可在体外促进小鼠B细胞生长发育,并充当胸腺细胞增殖的共刺激物。由于TSLP是2型炎症通路上游,针对TSLP的靶向治疗有望成为控制2型炎症型疾病的重要方法。特泽鲁单抗(tezepelumab)是TSLP单克隆抗体研究结果,在2021年被FDA批准用于治疗药物控制不良的中重度哮喘患者。
本文重点介绍TSLP与2型炎症通路及抗TSLP药物临床研究结果,讨论可能从抗TSLP治疗中受益的患者表型,并展望抗TSLP在2型炎症型疾病中新应用前景。
1、TSLP与2型炎症通路
1.1 TSLP生物学功能
TSLP是IL-7的远距离旁系同源物。人TSLP基因位于染色体5q22.1上[2],紧邻5q31上特应性细胞因子簇。2001年TSLP受体(TLSP receptor,TLSPR)和TSLP受体复合物在基因组数据库的计算筛选中被发现,前者在DC、ILC2、肥大细胞(mast cell,MC)、嗜酸性粒细胞(eosinophil,Eos)、气道平滑肌细胞、单核巨噬细胞和淋巴细胞上均有表达,提示TSLP有广泛的生物学作用;后者是由TLSPR和白细胞介素-7受体α链(interleukin-7 receptor subunit alpha,IL-7Rα)组成的异二聚体受体复合物。TSLP与TSLPR低亲和度结合,和异二聚体复合物受体高亲和度结合。
在2型炎症复杂的级联反应中,过敏原、污染物、微生物、生物化学制剂等刺激会促进上皮细胞释放[3-4]TSLP等警报素。一方面,TSLP刺激ILC2[5]产生IL-4、IL-13、IL-9及共刺激分子OX40L[6],并和IL-4及OX40L共同促进CD4+T细胞增殖,产生更多2型细胞因子。另一方面,TSLP通过刺激DC细胞表面的CD40和CD80表达激活CD11c+DC[7],使后者产生Th2趋化因子胸腺和激活调节趋化因子(TARC/CCL17)和巨噬细胞衍生趋化因子(MDC/CCL22),诱导幼稚CD4+T细胞增殖和表达IL-4、IL-5、IL-13、TNF-α,并抑制IL-10、IFN-γ的表达,进一步创造Th2极化微环境。微环境中的IL-4驱动B淋巴细胞转换为浆细胞并产生特异性IgE,结合于效应肥大细胞和嗜碱性粒细胞表面;IL-5可激活趋化嗜酸性粒细胞;IL-13(以及较少的IL-4)导致平滑肌收缩和杯状细胞化生,分泌更多黏液,促进上皮损伤修复[8]。
TSLP是一种多效性细胞因子,在多个信号通路中发挥重要作用。气道炎症期间,TSLP直接或间接触发STAT5磷酸化以及Bcl-xL抗凋亡蛋白的表达。研究发现,对于重度皮质类固醇控制不良的哮喘患者来说,皮质类固醇无法抑制由TSLP诱导的丝裂原活化蛋白激酶激酶(MEK)和pSTAT5表达[9]。此外,NF-κB配体受体激活因子(RANKL)可能通过激活PI3K、MAPK、caspase-1和NF-κB通路产生TSLP,但RANKL诱导的炎症反应可被皮质类固醇抑制[10]。上述研究提示,抗TSLP作为皮质类固醇的附加治疗,在皮质类固醇抵抗的2型炎症相关疾病中有很好的应用前景。
1.2 TSLP长短亚型
早在2009年,Harada等[11]团队就已报道了两种TSLPmRNA亚型。在对人支气管上皮细胞中TSLP基因的单核苷酸多态性(SNP)进行分析后发现,长型TSLP(lfTSLP)mRNA启动子区域存在一个转录因子激活蛋白结合位点,该功能变体增加了转录因子的结合,从而增加了lfTSLP的表达。该研究团队随后发现[12]短型TSLP(sfTSLP)mRNA的63个氨基酸的序列与长型C末端同源。
长短亚型TSLP在不同的疾病中起着不同的作用。在过敏性疾病以及炎症性肠病[13],有研究针对两种亚型在体内外的差异表达和生物活性研究后发现,两种TSLP亚型具有相反的免疫功能[14]。炎症期间,Chromobox4(CBX4)通过增强转录因子TFII-I类泛素化(SUMOylation)促进MEX-3B基因转录,后者通过其K同源结构域结合lfTSLPmRNA来促进lfTSLP 翻译[15];除此之外,lfTSLP还可通过miR-223/VHL/HIF-1α通路促进炎性细胞因子产生,增强气道上皮细胞的有氧糖酵解,引起气道高反应,促进哮喘的发生发展[16]。而sfTSLP是TSLP的主要存在形式,在稳态中表达,通过竞争受体复合物中lfTSLP结合位点和影响炎性细胞因子的产生发挥抗炎作用[17]。但在肿瘤中,两种TSLP亚型都可能参与肺癌的发生发展,且sfTSLP被发现在人卵巢癌和子宫内膜癌的细胞系和肿瘤组织中表达[18]。对TSLP亚型的研究进一步说明,TSLP作用广泛,在不同的疾病状态中扮演不同的角色。
2、抗TSLP治疗研究现状
2.1 特泽鲁单抗
特泽鲁单抗用于哮喘治疗:特泽鲁单抗(tezepelumab)是一种IgG2λ型抗TSLP人源单克隆抗体,2021年被FDA批准用于中重度控制不良哮喘患者的治疗。此前,一项关于特泽鲁单抗治疗青少年和成人重度控制不良哮喘患者的多中心随机对照Ⅲ期临床试验纳入1 061例受试者,其中529例接受特泽鲁单抗治疗,532例接受安慰剂治疗,试验组接受210 mg特泽鲁单抗或安慰剂皮下注射治疗,4周一次,持续52周[19]。研究显示,特泽鲁单抗组的哮喘发作年化率为 0.93(95%CI,0.80~1.07),安慰剂组为 2.10(95%CI,1.84~2.39)(RR,0.44;95%CI,0.37~0.53;P<0.001)。在基线期血嗜酸性粒细胞计数低于300个/μl的患者中,特泽鲁单抗组的哮喘发作年化率为1.02(95%CI,0.84~1.23),安慰剂组为1.73(95%CI,1.46~2.05)(RR,0.59;95%CI,0.46~0.75;P<0.001)。提示不论基线血嗜酸性粒细胞计数如何,特泽鲁单抗都可显著降低哮喘年化恶化率。同时,与安慰剂相比,特泽鲁单抗在第一秒呼气量(forced expiratory volume in the first second,FEV1)(95%CI,0.08~0.18)和简化版哮喘控制调查问卷(asthma control questionnaire,ACQ)-6(95%CI,-0.46~-0.20)、哮喘生命质量问卷(asthma quality of life questionnaire,AQLQ)(95%CI,0.20~0.47)和哮喘症状日记ASD(95%CI,-0.19~-0.04)评分方面有明显的改善,大幅减少了住院或在急诊就诊以及病情恶化的情况。两组间不良反应发生率差异无统计学意义。同时特泽鲁单抗也降低了血嗜酸性粒细胞数量、呼出气一氧化氮(FeNO)以及IgE的水平。另一项多中心随机对照Ⅱ期临床试验纳入116例中重度控制不良成年哮喘患者,试验组使用210 mg特泽鲁单抗皮下注射,4周给药一次,持续28周[4]。结果显示,与安慰剂相比,特泽鲁单抗治疗组的气道粘膜下嗜酸性粒细胞大幅下降(95%CI,0.05~0.41),而中性粒细胞(95%CI,0.94~1.97)、CD3+T细胞(95%CI,0.86~1.46)、CD4+T细胞(95%CI,0.90~1.55)、类胰蛋白酶+肥大细胞(95%CI,0.61~1.15)、糜蛋白酶+肥大细胞(95%CI,0.67~2.10)没有明显影响。不良反应发生率在两组间同样无统计学差异。
此外,大量多中心随机对照临床试验证实,无论中重度控制不良哮喘患者最初的2型炎症标志物基线如何,特泽鲁单抗均可减少多种2型炎症标志物水平[20-21]。部分研究表明,与安慰剂相比,特泽鲁单抗显著改善了重度未控制哮喘患者的肺功能和健康相关生活质量(health regulated quality of life,HRQoL),减少了患者活动障碍和社会心理影响[22]。特泽鲁单抗可迅速改善早晚的呼气峰值流速(peak expiratory flow rate,PEF)[23-24],治疗第1周就观察到效果,并在整个治疗期间持续改善PEF,提示特泽普鲁单抗可快速、持续地改善重度控制不良哮喘患者的肺功能。这些证据说明,特泽鲁单抗抑制了多种炎症途径,并在改善哮喘急性加重、肺功能、哮喘控制和患者生活质量方面都有明显作用,进一步说明抗TSLP治疗机制可能不仅仅针对2型炎症。
特泽鲁单抗用于特应性皮炎治疗:Parnes等[25]的一项随机对照单剂量递增Ⅰ期临床试验评估了特泽鲁单抗在人体中的初始安全性、药代动力学特征及其在特应性皮炎中的初步临床疗效。该试验纳入64名健康和14名特应性皮炎成人受试者,结果显示当单剂量皮下注射2.1~420 mg、静脉注射210~700 mg以及多剂量皮下注射35~210 mg、静脉注射700 mg时,特泽鲁单抗呈现出线性药代动力学模式。这些结果使后续研究中的剂量和方案选择成为可能。Simpson等[26]发表了一项随机对照Ⅱa期临床研究,该研究纳入113例中重度特应性皮炎患者,随机分配至每2周皮下注射280 mg特泽鲁单抗组或安慰剂组,同时联合外用皮质类固醇(TCS)治疗。结果显示,特泽鲁单抗治疗组在第12周湿疹面积和严重程度指数(EASI50)减少≥50%的发生率高于安慰剂组,并在第16周进一步改善。两组间的不良事件发生率相似。
从安全性讲,虽然上述研究都报道了试验组与对照组的不良反应发生率无统计学差异,甚至Diver等[4]的研究证明特泽鲁单抗不减少中性粒细胞和T细胞数量,提示特泽鲁单抗对固有免疫系统缺乏影响。但也曾有研究报道TSLP增强了中性粒细胞介导的耐甲氧西林金黄色葡萄球菌的杀伤作用[3,27],这对于伴有病原微生物感染的哮喘患者非常重要,应该进一步探讨特泽鲁单抗治疗对固有免疫系统的影响。此外,以上研究都针对成人或青少年,儿童及其他人群应用特泽鲁单抗的安全性及有效性还需要更多数据支持。
2.2 CSJ117
CSJ117是一种抗TSLP强效中和抗体片段,通过吸入途径治疗哮喘。Gauvreau等[28]首先报告了一项纳入28例轻度哮喘患者的随机对照研究,患者随机接受CSJ117(n=15)或安慰剂(n=13)治疗,持续12周。在随机分配当天、第42天和第84天进行过敏原吸入激发试验(allergen inhalation provocation test,AIC)。结果显示CSJ117在第84天减少了过敏原激发后的晚期哮喘反应和早期哮喘反应。与安慰剂组相比,CSJ117组患者的低FEV1明显较高且FeNO降低。不良反应在两组间无统计学差异。该研究团队又在另一项随机对照研究中,用同样的方法纳入28例轻度哮喘患者并进行AIC,结果显示CSJ117显著降低第84天AIC诱导的痰嗜酸性粒细胞百分比[29]。同时该团队在另一项随机对照临床试验中采用相同方法建立试验组与对照组,分别在三次AIC前24 h、AIC后7 h、24 h进行RNA测序(RNA-seq)[30]。研究显示过敏原诱发了痰中明显的基因表达变化,与安慰剂相比,CSJ117对IL-4反应基因及IL-13信号传导等路径有明显影响。
这些研究表明CSJ117作为第一种吸入式抗TSLP药物,在成年轻度哮喘病人中安全性好。CSJ117降低了过敏引起的支气管收缩和痰嗜酸性粒细胞增多,以及激发试验前的FeNO水平,同时在分子层面影响2型炎症因子的表达。进一步说明CSJ117吸入性抗TSLP治疗可能是治疗哮喘的新疗法。
2.3 其他抗TSLP疗法
BSI-045B:另一种抗TSLP单克隆抗体是BSI-045B[3],该单克隆抗体针对特应性皮炎的随机对照1期临床试验研究正在进行中。这项研究使用随机、双盲、安慰剂评估健康成人和特应性皮炎患者注射BSI-045B后的安全性、耐受性。该研究已在ClinicalTrials.gov上注册(NCT05114889),尚未检索到该试验结果发表信息。
Zweimab和Doppelmab:由于2型炎症信号通路的大量重叠,及TSLP和白细胞介素13(IL-13)两种细胞因子在严重哮喘患者气道上皮和固有层**同表达[31],有团队研究双重靶向TSLP和IL-13[32]药物。该研究团队设计、开发了名为Zweimab的单价双特异性抗体和名为Doppelmab的双价双特异性抗体支架靶向TSLP和IL-13。Zweimab是重链存在knobin-hole突变的异二聚体。Doppelmab具有scFv(单链片段可变)部分,通过短多肽接头连接到CH3结构域。该试验表明,抗TSLP/IL-13抗体如Zweimab和Doppelmab具有非常强的亲和力。
TSLP-traps:有研究显示,受体复合物胞外结构域串联而成的受体融合蛋白与特泽鲁单抗一样可显著抑制TSLP驱动的DC激活[33-34]。TSLP-traps是受体复合物胞外区域与(Gly-Gly-Ser)20 连接子融合形成的受体融合蛋白,分为TSLP-trap1和TSLP-trap2,它们利用受体复合物错综复杂的机制表现出高拮抗效力。
TSLP小分子抑制剂:黄芩的主要有效成分之一联苯黄酮类似物黄芩素是人TSLP信号通路的第一个小分子抑制剂[35],可通过阻断人TSLP及受体之间的相互作用,有效减少呼吸道嗜酸性粒细胞炎症。还有研究表明新型化合物2-(4-{2-[(苯硫基)乙酰基]碳酰肼}-苯氧基)乙酰胺(2-(4-{2-[(phenylthio)acetyl]carbonohydrazonoyl}phenoxy)acetamide,PA)[36]以及薰衣草主要成分之一的乙酸芳樟酯[37]通过阻断肥大细胞中的caspase-1,抑制TSLPmRNA的表达和产生,进而降低TSLP;体外试验表明PA减少了致敏小鼠鼻黏膜组织中的嗜酸性粒细胞和肥大细胞数量[38]。而一种天然存在的氧化还原辅助因子和营养素吡咯并喹啉醌(pyrroloquinoline quinone,PQQ)[39]显著降低TSLP的产生,并在体外抑制Th2细胞分化,PQQ可显著减少小鼠支气管肺泡灌洗液中的炎症细胞计数。苦参酚F用于治疗特应性皮炎也降低了嗜酸性粒细胞和肥大细胞浸润以及TSLP表达水平[40],体外试验显示苦参酚F减轻小鼠耳朵增厚和抓挠行为,并降低血清组胺、IgE和Ig***平。而薰衣草油的主要成分之一乙酸芳樟酯(linalyl acetate,LA)可以减轻痛觉、降低促炎细胞因子和TSLP受体复合物的表达[41]。上述研究表明,抗TSLP小分子抑制剂是治疗2型炎症型疾病的潜在候选物。
3、抗TSLP治疗潜在受益人群
3.1 过敏性疾病
如前所述,有大量抗TSLP治疗哮喘的研究发表,用以针对不同内型的哮喘患者,包括低2型炎症标志物型哮喘,其中特泽鲁单抗 于2021年12月17日首次获得FDA批准,作为12岁及以上重度哮喘患者的附加治疗,它也是唯一被批准用于没有表型或生物标志物限制的重度哮喘的生物制剂。同时该单抗正在进行特应性皮炎[25-26,40],过敏性鼻炎,慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)慢性气道炎症,慢性鼻窦炎伴鼻息肉,嗜酸性粒细胞性食管炎,及慢性自发性荨麻疹的临床开发[42](图1)。近年大量研究证实嗜酸性粒细胞性食管炎患者食管组织中的TSLP表达增加[43]。中重度慢性鼻窦炎患者的TSLP等2型炎症相关介质表达上调[44],从表观遗传学角度得出,TSLP的启动子在慢性鼻窦炎伴鼻息肉(chronic rhinosinusitis with nasal polyp,CRSwNP)中高甲基化[45],说明TSLP与CRSwNP的发病机制相关,提示这些患者可能受益于抗TSLP治疗。
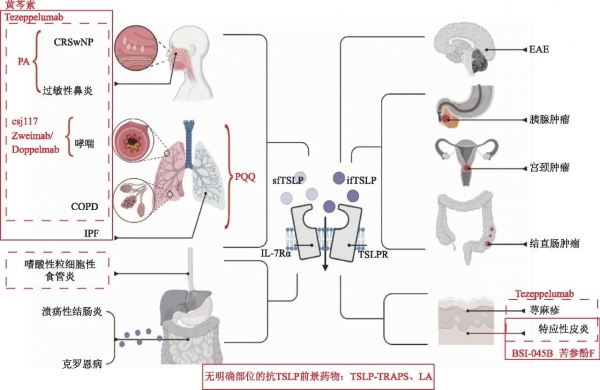
图1 TSLP研究现状及药物治疗
TSLP:胸腺基质淋巴细胞生成素;CRSwNP:慢性鼻窦炎伴鼻息肉;COPD:慢性阻塞性肺病;IPF:肺纤维化;EAE:自身免疫性脑脊髓炎;PA:2-(4-{2-[(苯硫基)乙酰基]碳酰肼}-苯氧基)乙酰胺;PQQ:吡咯并喹啉醌;LA:乙酸芳樟酯;lfTSLP:长型TSLP;sfTSLP:短型TSLP;TLSPR:TSLP受体;IL-7Rα:白细胞介素-7受体α链
3.2 炎症性肠病
2017年的一项研究显示,TSLP是炎症性肠病(inflammatory bowel disease,IBD)发病机制中的关键介质,TSLP的减少有可能加速(如克罗恩病)的发展,而TSLP的增加有可能导致2型炎症型疾病(如溃疡性结肠炎)的发展[46]。另一项研究团队证实,溃疡性结肠炎患者结肠上皮细胞中,过氧化物酶体增值物受体γ(peroxisome proliferator-activated receptor-γ,PPARγ)的表达下调[47]。sfTSLP受PPARγ的调节,sfTSLP在PPARγ敲除的细胞和用PPARγ拮抗剂处理的细胞中表达下降,而PPARγ激动剂则诱导了sfTSLP的表达[13]。由于sfTSLP维持机体稳态,因此拮抗sfTSLP可能促进溃疡性结肠的进展。
3.3 肿瘤
TSLP对固有免疫和适应性免疫都有广泛影响,可在各种肿瘤中发挥直接或间接作用,但在部分对肿瘤的研究中TSLP作用存在争议。有研究发现,缺氧导致的肿瘤病灶中高水平TSLP通过募集肿瘤相关嗜酸性粒细胞促进宫颈癌细胞的生长[48]。Obata-Ninomiya等[49]使用TSLP特异性单克隆抗体阻断TSLP可有效抑制小鼠模型中结直肠肿瘤的进展。De Monte等[50]认为2型炎症反应在胰腺癌进展中起积极作用,TSLP利于Th2细胞极化,抗TSLP可能有助于改善胰腺癌预后。Yao等[51]的研究说明,皮肤恶性黑色素瘤诱导生成TSLP,促进黑色素瘤的进展和转移。Takahashi等[52]研究证实TSLP不仅在皮肤T细胞淋巴瘤(cutaneous T cell lymphoma,CTCL)中诱导Th2显性肿瘤环境,并且直接刺激CTCL肿瘤细胞生长。TSLP在乳腺肿瘤中通过诱导抗凋亡分子Bcl-2的表达促进肿瘤细胞的存活,并促进乳腺肿瘤肺转移[53],抗TSLP在模型中抑制乳腺肿瘤生长[54]。与之相反的是Demehri等[55]证明TSLP可诱导小鼠对早期乳腺癌的强大抗肿瘤免疫力,Boieri等[56]研究同样支持Th2细胞直接阻断乳腺癌的发生。而针对皮肤癌的研究显示TSLP可在屏障缺陷的皮肤中诱导强大的抗肿瘤免疫力[57]。上述研究提示,TSLP与多种肿瘤的发生发展相关,部分肿瘤患者有可能受益于抗TSLP治疗,但仍需进一步研究证明。
3.4 其他
TSLP在特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)中高表达,被认为是肺纤维化疾病的主要驱动因素,而肿瘤坏死因子超家族蛋白14(tumor necrosis factor superfamily 14,TNFSF14,又名LIGHT)可能是肺纤维化疾病发生和发展过程中TSLP产生的关键驱动因素[58]。TSLP在自身免疫性疾病中的作用尚不清楚,且同样存在争议。2022年Yu等[59]的一项研究证明,与野生型小鼠相比,缺乏TSLPR的小鼠诱导自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)后,试验性EAE评分明显下降,CD4+T细胞浸润减少,大脑中髓鞘基本蛋白(myelin basic protein,MBP)表达恢复,证实TSLPR通过JAK2发出信号,诱导NLRP3的表达,确定了TSLP是治疗JAK2-NLRP3轴相关的自身免疫性炎症疾病的一个潜在目标。虽然多数试验都支持靶向TSLP对自身免疫性疾病有益,但也有研究发现,广泛用于银屑病治疗的局部用药VD3A在小鼠模型中可通过诱导TSLP产生,从而改善银屑病斑块[60]。
4、结论
TSLP作用广泛,是2型炎症相关型疾病机制(尤其是过敏性疾病)的上游细胞因子之一。抗TSLP单克隆抗体特泽鲁单抗被FDA批准用于中重度药物控制不良哮喘患者的附加治疗,临床试验证明特泽鲁单抗的抗TSLP治疗有更广泛的通路,而不仅仅针对2型炎症,并且有望应用于其他2型炎症相关疾病(如特应性皮炎)的治疗。其他抗TSLP治疗也正在开发中。
但目前大多数针对TSLP的药物研究并未区分lfTSLP及sfTSLP,而在治疗过敏性疾病或炎症性肠病时,靶向TSLP的C末端可能会影响sfTSLP的稳态和抗炎作用进而引起药物不良反应。理想状态下,用于中和TSLP的单克隆抗体不应相互作用或阻碍sfTSLP的稳态作用。此外,TSLP的不同亚型在不同肿瘤中的作用及机制尚存在争议。因此,仍需要大量研究探究其机制通路,以阐明抗TSLP治疗潜在的不良反应和拓宽抗TSLP临床应用。
参考文献:略.
作者:李泐,祝戎飞
来源:中华临床免疫和变态反应杂志 公众号
( 转载文章系出于传递学术分享之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请通过 邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。)
2024-03-20 16:44:37 9281 浏览
【关键词】特泽鲁单抗;2型炎症;哮喘;胸腺基质淋巴细胞生成素
近年来,2型免疫反应逐步从“树突细胞(dendritic cell,DC)-2型T辅助细胞(Th2)轴”拓展为“2型固有淋巴样细胞(type 2 innate lymphoid cell,ILC2)-DC-Th2轴”,而2型免疫的失衡将导致2型炎症,引起哮喘、过敏性鼻炎、特应性皮炎等疾病[1]。针对2型炎症通路的干预措施可成为这类疾病的治疗靶点,以有效防治相关疾病。目前,局部或全身用激素控制不良的2型炎症相关疾病可以考虑生物制剂疗法,但现有生物制剂多针对2型炎症下游细胞因子,如IgE、白细胞介素(interleukin,IL)-4R、IL-5等,不能完全涵盖2型炎症通路,部分患者对这些药物的应答欠佳。因此,需要开发更有效的治疗策略管理2型炎症相关型疾病。
胸腺基质淋巴细胞生成素(thymic stromal lymphopoietin,TSLP)是一种上皮细胞衍生细胞因子,最初于1994年在鼠胸腺基质细胞系的上清液中被发现。2001年有研究发现TSLP可在体外促进小鼠B细胞生长发育,并充当胸腺细胞增殖的共刺激物。由于TSLP是2型炎症通路上游,针对TSLP的靶向治疗有望成为控制2型炎症型疾病的重要方法。特泽鲁单抗(tezepelumab)是TSLP单克隆抗体研究结果,在2021年被FDA批准用于治疗药物控制不良的中重度哮喘患者。
本文重点介绍TSLP与2型炎症通路及抗TSLP药物临床研究结果,讨论可能从抗TSLP治疗中受益的患者表型,并展望抗TSLP在2型炎症型疾病中新应用前景。
1、TSLP与2型炎症通路
1.1 TSLP生物学功能
TSLP是IL-7的远距离旁系同源物。人TSLP基因位于染色体5q22.1上[2],紧邻5q31上特应性细胞因子簇。2001年TSLP受体(TLSP receptor,TLSPR)和TSLP受体复合物在基因组数据库的计算筛选中被发现,前者在DC、ILC2、肥大细胞(mast cell,MC)、嗜酸性粒细胞(eosinophil,Eos)、气道平滑肌细胞、单核巨噬细胞和淋巴细胞上均有表达,提示TSLP有广泛的生物学作用;后者是由TLSPR和白细胞介素-7受体α链(interleukin-7 receptor subunit alpha,IL-7Rα)组成的异二聚体受体复合物。TSLP与TSLPR低亲和度结合,和异二聚体复合物受体高亲和度结合。
在2型炎症复杂的级联反应中,过敏原、污染物、微生物、生物化学制剂等刺激会促进上皮细胞释放[3-4]TSLP等警报素。一方面,TSLP刺激ILC2[5]产生IL-4、IL-13、IL-9及共刺激分子OX40L[6],并和IL-4及OX40L共同促进CD4+T细胞增殖,产生更多2型细胞因子。另一方面,TSLP通过刺激DC细胞表面的CD40和CD80表达激活CD11c+DC[7],使后者产生Th2趋化因子胸腺和激活调节趋化因子(TARC/CCL17)和巨噬细胞衍生趋化因子(MDC/CCL22),诱导幼稚CD4+T细胞增殖和表达IL-4、IL-5、IL-13、TNF-α,并抑制IL-10、IFN-γ的表达,进一步创造Th2极化微环境。微环境中的IL-4驱动B淋巴细胞转换为浆细胞并产生特异性IgE,结合于效应肥大细胞和嗜碱性粒细胞表面;IL-5可激活趋化嗜酸性粒细胞;IL-13(以及较少的IL-4)导致平滑肌收缩和杯状细胞化生,分泌更多黏液,促进上皮损伤修复[8]。
TSLP是一种多效性细胞因子,在多个信号通路中发挥重要作用。气道炎症期间,TSLP直接或间接触发STAT5磷酸化以及Bcl-xL抗凋亡蛋白的表达。研究发现,对于重度皮质类固醇控制不良的哮喘患者来说,皮质类固醇无法抑制由TSLP诱导的丝裂原活化蛋白激酶激酶(MEK)和pSTAT5表达[9]。此外,NF-κB配体受体激活因子(RANKL)可能通过激活PI3K、MAPK、caspase-1和NF-κB通路产生TSLP,但RANKL诱导的炎症反应可被皮质类固醇抑制[10]。上述研究提示,抗TSLP作为皮质类固醇的附加治疗,在皮质类固醇抵抗的2型炎症相关疾病中有很好的应用前景。
1.2 TSLP长短亚型
早在2009年,Harada等[11]团队就已报道了两种TSLPmRNA亚型。在对人支气管上皮细胞中TSLP基因的单核苷酸多态性(SNP)进行分析后发现,长型TSLP(lfTSLP)mRNA启动子区域存在一个转录因子激活蛋白结合位点,该功能变体增加了转录因子的结合,从而增加了lfTSLP的表达。该研究团队随后发现[12]短型TSLP(sfTSLP)mRNA的63个氨基酸的序列与长型C末端同源。
长短亚型TSLP在不同的疾病中起着不同的作用。在过敏性疾病以及炎症性肠病[13],有研究针对两种亚型在体内外的差异表达和生物活性研究后发现,两种TSLP亚型具有相反的免疫功能[14]。炎症期间,Chromobox4(CBX4)通过增强转录因子TFII-I类泛素化(SUMOylation)促进MEX-3B基因转录,后者通过其K同源结构域结合lfTSLPmRNA来促进lfTSLP 翻译[15];除此之外,lfTSLP还可通过miR-223/VHL/HIF-1α通路促进炎性细胞因子产生,增强气道上皮细胞的有氧糖酵解,引起气道高反应,促进哮喘的发生发展[16]。而sfTSLP是TSLP的主要存在形式,在稳态中表达,通过竞争受体复合物中lfTSLP结合位点和影响炎性细胞因子的产生发挥抗炎作用[17]。但在肿瘤中,两种TSLP亚型都可能参与肺癌的发生发展,且sfTSLP被发现在人卵巢癌和子宫内膜癌的细胞系和肿瘤组织中表达[18]。对TSLP亚型的研究进一步说明,TSLP作用广泛,在不同的疾病状态中扮演不同的角色。
2、抗TSLP治疗研究现状
2.1 特泽鲁单抗
特泽鲁单抗用于哮喘治疗:特泽鲁单抗(tezepelumab)是一种IgG2λ型抗TSLP人源单克隆抗体,2021年被FDA批准用于中重度控制不良哮喘患者的治疗。此前,一项关于特泽鲁单抗治疗青少年和成人重度控制不良哮喘患者的多中心随机对照Ⅲ期临床试验纳入1 061例受试者,其中529例接受特泽鲁单抗治疗,532例接受安慰剂治疗,试验组接受210 mg特泽鲁单抗或安慰剂皮下注射治疗,4周一次,持续52周[19]。研究显示,特泽鲁单抗组的哮喘发作年化率为 0.93(95%CI,0.80~1.07),安慰剂组为 2.10(95%CI,1.84~2.39)(RR,0.44;95%CI,0.37~0.53;P<0.001)。在基线期血嗜酸性粒细胞计数低于300个/μl的患者中,特泽鲁单抗组的哮喘发作年化率为1.02(95%CI,0.84~1.23),安慰剂组为1.73(95%CI,1.46~2.05)(RR,0.59;95%CI,0.46~0.75;P<0.001)。提示不论基线血嗜酸性粒细胞计数如何,特泽鲁单抗都可显著降低哮喘年化恶化率。同时,与安慰剂相比,特泽鲁单抗在第一秒呼气量(forced expiratory volume in the first second,FEV1)(95%CI,0.08~0.18)和简化版哮喘控制调查问卷(asthma control questionnaire,ACQ)-6(95%CI,-0.46~-0.20)、哮喘生命质量问卷(asthma quality of life questionnaire,AQLQ)(95%CI,0.20~0.47)和哮喘症状日记ASD(95%CI,-0.19~-0.04)评分方面有明显的改善,大幅减少了住院或在急诊就诊以及病情恶化的情况。两组间不良反应发生率差异无统计学意义。同时特泽鲁单抗也降低了血嗜酸性粒细胞数量、呼出气一氧化氮(FeNO)以及IgE的水平。另一项多中心随机对照Ⅱ期临床试验纳入116例中重度控制不良成年哮喘患者,试验组使用210 mg特泽鲁单抗皮下注射,4周给药一次,持续28周[4]。结果显示,与安慰剂相比,特泽鲁单抗治疗组的气道粘膜下嗜酸性粒细胞大幅下降(95%CI,0.05~0.41),而中性粒细胞(95%CI,0.94~1.97)、CD3+T细胞(95%CI,0.86~1.46)、CD4+T细胞(95%CI,0.90~1.55)、类胰蛋白酶+肥大细胞(95%CI,0.61~1.15)、糜蛋白酶+肥大细胞(95%CI,0.67~2.10)没有明显影响。不良反应发生率在两组间同样无统计学差异。
此外,大量多中心随机对照临床试验证实,无论中重度控制不良哮喘患者最初的2型炎症标志物基线如何,特泽鲁单抗均可减少多种2型炎症标志物水平[20-21]。部分研究表明,与安慰剂相比,特泽鲁单抗显著改善了重度未控制哮喘患者的肺功能和健康相关生活质量(health regulated quality of life,HRQoL),减少了患者活动障碍和社会心理影响[22]。特泽鲁单抗可迅速改善早晚的呼气峰值流速(peak expiratory flow rate,PEF)[23-24],治疗第1周就观察到效果,并在整个治疗期间持续改善PEF,提示特泽普鲁单抗可快速、持续地改善重度控制不良哮喘患者的肺功能。这些证据说明,特泽鲁单抗抑制了多种炎症途径,并在改善哮喘急性加重、肺功能、哮喘控制和患者生活质量方面都有明显作用,进一步说明抗TSLP治疗机制可能不仅仅针对2型炎症。
特泽鲁单抗用于特应性皮炎治疗:Parnes等[25]的一项随机对照单剂量递增Ⅰ期临床试验评估了特泽鲁单抗在人体中的初始安全性、药代动力学特征及其在特应性皮炎中的初步临床疗效。该试验纳入64名健康和14名特应性皮炎成人受试者,结果显示当单剂量皮下注射2.1~420 mg、静脉注射210~700 mg以及多剂量皮下注射35~210 mg、静脉注射700 mg时,特泽鲁单抗呈现出线性药代动力学模式。这些结果使后续研究中的剂量和方案选择成为可能。Simpson等[26]发表了一项随机对照Ⅱa期临床研究,该研究纳入113例中重度特应性皮炎患者,随机分配至每2周皮下注射280 mg特泽鲁单抗组或安慰剂组,同时联合外用皮质类固醇(TCS)治疗。结果显示,特泽鲁单抗治疗组在第12周湿疹面积和严重程度指数(EASI50)减少≥50%的发生率高于安慰剂组,并在第16周进一步改善。两组间的不良事件发生率相似。
从安全性讲,虽然上述研究都报道了试验组与对照组的不良反应发生率无统计学差异,甚至Diver等[4]的研究证明特泽鲁单抗不减少中性粒细胞和T细胞数量,提示特泽鲁单抗对固有免疫系统缺乏影响。但也曾有研究报道TSLP增强了中性粒细胞介导的耐甲氧西林金黄色葡萄球菌的杀伤作用[3,27],这对于伴有病原微生物感染的哮喘患者非常重要,应该进一步探讨特泽鲁单抗治疗对固有免疫系统的影响。此外,以上研究都针对成人或青少年,儿童及其他人群应用特泽鲁单抗的安全性及有效性还需要更多数据支持。
2.2 CSJ117
CSJ117是一种抗TSLP强效中和抗体片段,通过吸入途径治疗哮喘。Gauvreau等[28]首先报告了一项纳入28例轻度哮喘患者的随机对照研究,患者随机接受CSJ117(n=15)或安慰剂(n=13)治疗,持续12周。在随机分配当天、第42天和第84天进行过敏原吸入激发试验(allergen inhalation provocation test,AIC)。结果显示CSJ117在第84天减少了过敏原激发后的晚期哮喘反应和早期哮喘反应。与安慰剂组相比,CSJ117组患者的低FEV1明显较高且FeNO降低。不良反应在两组间无统计学差异。该研究团队又在另一项随机对照研究中,用同样的方法纳入28例轻度哮喘患者并进行AIC,结果显示CSJ117显著降低第84天AIC诱导的痰嗜酸性粒细胞百分比[29]。同时该团队在另一项随机对照临床试验中采用相同方法建立试验组与对照组,分别在三次AIC前24 h、AIC后7 h、24 h进行RNA测序(RNA-seq)[30]。研究显示过敏原诱发了痰中明显的基因表达变化,与安慰剂相比,CSJ117对IL-4反应基因及IL-13信号传导等路径有明显影响。
这些研究表明CSJ117作为第一种吸入式抗TSLP药物,在成年轻度哮喘病人中安全性好。CSJ117降低了过敏引起的支气管收缩和痰嗜酸性粒细胞增多,以及激发试验前的FeNO水平,同时在分子层面影响2型炎症因子的表达。进一步说明CSJ117吸入性抗TSLP治疗可能是治疗哮喘的新疗法。
2.3 其他抗TSLP疗法
BSI-045B:另一种抗TSLP单克隆抗体是BSI-045B[3],该单克隆抗体针对特应性皮炎的随机对照1期临床试验研究正在进行中。这项研究使用随机、双盲、安慰剂评估健康成人和特应性皮炎患者注射BSI-045B后的安全性、耐受性。该研究已在ClinicalTrials.gov上注册(NCT05114889),尚未检索到该试验结果发表信息。
Zweimab和Doppelmab:由于2型炎症信号通路的大量重叠,及TSLP和白细胞介素13(IL-13)两种细胞因子在严重哮喘患者气道上皮和固有层**同表达[31],有团队研究双重靶向TSLP和IL-13[32]药物。该研究团队设计、开发了名为Zweimab的单价双特异性抗体和名为Doppelmab的双价双特异性抗体支架靶向TSLP和IL-13。Zweimab是重链存在knobin-hole突变的异二聚体。Doppelmab具有scFv(单链片段可变)部分,通过短多肽接头连接到CH3结构域。该试验表明,抗TSLP/IL-13抗体如Zweimab和Doppelmab具有非常强的亲和力。
TSLP-traps:有研究显示,受体复合物胞外结构域串联而成的受体融合蛋白与特泽鲁单抗一样可显著抑制TSLP驱动的DC激活[33-34]。TSLP-traps是受体复合物胞外区域与(Gly-Gly-Ser)20 连接子融合形成的受体融合蛋白,分为TSLP-trap1和TSLP-trap2,它们利用受体复合物错综复杂的机制表现出高拮抗效力。
TSLP小分子抑制剂:黄芩的主要有效成分之一联苯黄酮类似物黄芩素是人TSLP信号通路的第一个小分子抑制剂[35],可通过阻断人TSLP及受体之间的相互作用,有效减少呼吸道嗜酸性粒细胞炎症。还有研究表明新型化合物2-(4-{2-[(苯硫基)乙酰基]碳酰肼}-苯氧基)乙酰胺(2-(4-{2-[(phenylthio)acetyl]carbonohydrazonoyl}phenoxy)acetamide,PA)[36]以及薰衣草主要成分之一的乙酸芳樟酯[37]通过阻断肥大细胞中的caspase-1,抑制TSLPmRNA的表达和产生,进而降低TSLP;体外试验表明PA减少了致敏小鼠鼻黏膜组织中的嗜酸性粒细胞和肥大细胞数量[38]。而一种天然存在的氧化还原辅助因子和营养素吡咯并喹啉醌(pyrroloquinoline quinone,PQQ)[39]显著降低TSLP的产生,并在体外抑制Th2细胞分化,PQQ可显著减少小鼠支气管肺泡灌洗液中的炎症细胞计数。苦参酚F用于治疗特应性皮炎也降低了嗜酸性粒细胞和肥大细胞浸润以及TSLP表达水平[40],体外试验显示苦参酚F减轻小鼠耳朵增厚和抓挠行为,并降低血清组胺、IgE和Ig***平。而薰衣草油的主要成分之一乙酸芳樟酯(linalyl acetate,LA)可以减轻痛觉、降低促炎细胞因子和TSLP受体复合物的表达[41]。上述研究表明,抗TSLP小分子抑制剂是治疗2型炎症型疾病的潜在候选物。
3、抗TSLP治疗潜在受益人群
3.1 过敏性疾病
如前所述,有大量抗TSLP治疗哮喘的研究发表,用以针对不同内型的哮喘患者,包括低2型炎症标志物型哮喘,其中特泽鲁单抗 于2021年12月17日首次获得FDA批准,作为12岁及以上重度哮喘患者的附加治疗,它也是唯一被批准用于没有表型或生物标志物限制的重度哮喘的生物制剂。同时该单抗正在进行特应性皮炎[25-26,40],过敏性鼻炎,慢性阻塞性肺病(chronic obstructive pulmonary disease,COPD)慢性气道炎症,慢性鼻窦炎伴鼻息肉,嗜酸性粒细胞性食管炎,及慢性自发性荨麻疹的临床开发[42](图1)。近年大量研究证实嗜酸性粒细胞性食管炎患者食管组织中的TSLP表达增加[43]。中重度慢性鼻窦炎患者的TSLP等2型炎症相关介质表达上调[44],从表观遗传学角度得出,TSLP的启动子在慢性鼻窦炎伴鼻息肉(chronic rhinosinusitis with nasal polyp,CRSwNP)中高甲基化[45],说明TSLP与CRSwNP的发病机制相关,提示这些患者可能受益于抗TSLP治疗。

图1 TSLP研究现状及药物治疗
TSLP:胸腺基质淋巴细胞生成素;CRSwNP:慢性鼻窦炎伴鼻息肉;COPD:慢性阻塞性肺病;IPF:肺纤维化;EAE:自身免疫性脑脊髓炎;PA:2-(4-{2-[(苯硫基)乙酰基]碳酰肼}-苯氧基)乙酰胺;PQQ:吡咯并喹啉醌;LA:乙酸芳樟酯;lfTSLP:长型TSLP;sfTSLP:短型TSLP;TLSPR:TSLP受体;IL-7Rα:白细胞介素-7受体α链
3.2 炎症性肠病
2017年的一项研究显示,TSLP是炎症性肠病(inflammatory bowel disease,IBD)发病机制中的关键介质,TSLP的减少有可能加速(如克罗恩病)的发展,而TSLP的增加有可能导致2型炎症型疾病(如溃疡性结肠炎)的发展[46]。另一项研究团队证实,溃疡性结肠炎患者结肠上皮细胞中,过氧化物酶体增值物受体γ(peroxisome proliferator-activated receptor-γ,PPARγ)的表达下调[47]。sfTSLP受PPARγ的调节,sfTSLP在PPARγ敲除的细胞和用PPARγ拮抗剂处理的细胞中表达下降,而PPARγ激动剂则诱导了sfTSLP的表达[13]。由于sfTSLP维持机体稳态,因此拮抗sfTSLP可能促进溃疡性结肠的进展。
3.3 肿瘤
TSLP对固有免疫和适应性免疫都有广泛影响,可在各种肿瘤中发挥直接或间接作用,但在部分对肿瘤的研究中TSLP作用存在争议。有研究发现,缺氧导致的肿瘤病灶中高水平TSLP通过募集肿瘤相关嗜酸性粒细胞促进宫颈癌细胞的生长[48]。Obata-Ninomiya等[49]使用TSLP特异性单克隆抗体阻断TSLP可有效抑制小鼠模型中结直肠肿瘤的进展。De Monte等[50]认为2型炎症反应在胰腺癌进展中起积极作用,TSLP利于Th2细胞极化,抗TSLP可能有助于改善胰腺癌预后。Yao等[51]的研究说明,皮肤恶性黑色素瘤诱导生成TSLP,促进黑色素瘤的进展和转移。Takahashi等[52]研究证实TSLP不仅在皮肤T细胞淋巴瘤(cutaneous T cell lymphoma,CTCL)中诱导Th2显性肿瘤环境,并且直接刺激CTCL肿瘤细胞生长。TSLP在乳腺肿瘤中通过诱导抗凋亡分子Bcl-2的表达促进肿瘤细胞的存活,并促进乳腺肿瘤肺转移[53],抗TSLP在模型中抑制乳腺肿瘤生长[54]。与之相反的是Demehri等[55]证明TSLP可诱导小鼠对早期乳腺癌的强大抗肿瘤免疫力,Boieri等[56]研究同样支持Th2细胞直接阻断乳腺癌的发生。而针对皮肤癌的研究显示TSLP可在屏障缺陷的皮肤中诱导强大的抗肿瘤免疫力[57]。上述研究提示,TSLP与多种肿瘤的发生发展相关,部分肿瘤患者有可能受益于抗TSLP治疗,但仍需进一步研究证明。
3.4 其他
TSLP在特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)中高表达,被认为是肺纤维化疾病的主要驱动因素,而肿瘤坏死因子超家族蛋白14(tumor necrosis factor superfamily 14,TNFSF14,又名LIGHT)可能是肺纤维化疾病发生和发展过程中TSLP产生的关键驱动因素[58]。TSLP在自身免疫性疾病中的作用尚不清楚,且同样存在争议。2022年Yu等[59]的一项研究证明,与野生型小鼠相比,缺乏TSLPR的小鼠诱导自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)后,试验性EAE评分明显下降,CD4+T细胞浸润减少,大脑中髓鞘基本蛋白(myelin basic protein,MBP)表达恢复,证实TSLPR通过JAK2发出信号,诱导NLRP3的表达,确定了TSLP是治疗JAK2-NLRP3轴相关的自身免疫性炎症疾病的一个潜在目标。虽然多数试验都支持靶向TSLP对自身免疫性疾病有益,但也有研究发现,广泛用于银屑病治疗的局部用药VD3A在小鼠模型中可通过诱导TSLP产生,从而改善银屑病斑块[60]。
4、结论
TSLP作用广泛,是2型炎症相关型疾病机制(尤其是过敏性疾病)的上游细胞因子之一。抗TSLP单克隆抗体特泽鲁单抗被FDA批准用于中重度药物控制不良哮喘患者的附加治疗,临床试验证明特泽鲁单抗的抗TSLP治疗有更广泛的通路,而不仅仅针对2型炎症,并且有望应用于其他2型炎症相关疾病(如特应性皮炎)的治疗。其他抗TSLP治疗也正在开发中。
但目前大多数针对TSLP的药物研究并未区分lfTSLP及sfTSLP,而在治疗过敏性疾病或炎症性肠病时,靶向TSLP的C末端可能会影响sfTSLP的稳态和抗炎作用进而引起药物不良反应。理想状态下,用于中和TSLP的单克隆抗体不应相互作用或阻碍sfTSLP的稳态作用。此外,TSLP的不同亚型在不同肿瘤中的作用及机制尚存在争议。因此,仍需要大量研究探究其机制通路,以阐明抗TSLP治疗潜在的不良反应和拓宽抗TSLP临床应用。
参考文献:略.
作者:李泐,祝戎飞
来源:中华临床免疫和变态反应杂志 公众号
( 转载文章系出于传递学术分享之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请通过 邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。)

 抢沙发,发首评,稳占C位!
立即抢沙发
抢沙发,发首评,稳占C位!
立即抢沙发




