Nature | 新发现!科学家确定引发痴呆症的新型蛋白质!
+关注
包括痴呆症在内的大多数神经变性疾病都会涉及蛋白质聚集形成一种称之为淀粉样蛋白的细丝状结构,在大多数这些疾病中,研究人员已经识别出了能发生聚集的蛋白质,从而就能促使他们针对这些蛋白质进行诊断测试和治疗。然而,在大约10%的额颞叶痴呆症病例中,科学家们尚未识别出这种流氓蛋白质。
近日,英国剑桥医学研究委员会(MRC)分子生物学实验室领导的研究团队发表在国际杂志Nature上题为“TAF15 amyloid filaments in frontotemporal lobar degeneration”的研究报告中,科学家们通过研究在额颞叶痴呆症病例中确定了蛋白质TAF15的聚集结构。
额颞叶痴呆是由大脑额叶和颞叶的退化所引起的,这两个大脑部位控制着机体的情绪、个性、行为以及言语和对词语的理解,其发病往往要比阿尔兹海默病更加年轻,通常会在45至65岁的人群中被诊断出来,尽管其还会影响年轻人和老年人。这项研究中,研究人员确定了一种特殊蛋白的聚集结构,这种蛋白质或有望未来帮助科学家们开发诊断测试技术和疗法。研究者Benjamin Ryskeldi-Falcon说道,这一研究发现或能改变我们对额颞叶痴呆症发病分子基础的理解,这是一项罕见的研究发现,研究人员发现了能在神经变性疾病中发生聚集的一小群蛋白质的新成员。
如今研究人员识别出了这种关键蛋白及其结构,他们就能开始针对这种类型的额颞叶痴呆进行诊断和治疗,类似于已经在开发的用于靶向作用β淀粉样蛋白聚集和tau蛋白聚集的策略,这些蛋白质是阿尔兹海默病发生的主要特征。如今科学家们使用先进的冷冻电镜技术能在院子分辨率下研究四名已患额颞叶痴呆症患者大脑中的蛋白质聚集物;长期以来,基于与其它神经变性疾病的相似性,在这种类型痴呆症的研究中,科学家们认为存在一种名为FUS的蛋白会发生聚集。而利用冷冻电镜技术,研究人员就能确定来自每个大脑组织中的蛋白聚集物或许具有相同的原子结构,而令人惊讶的是,这种蛋白质并不是FUS,而是另一种称之为TAF15的蛋白。
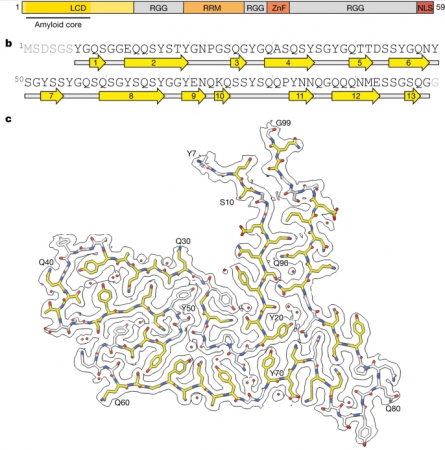
科学家识别出与人类额颞叶痴呆症发生相关的新型蛋白质。
图片来源:Nature (2023). DOI:10.1038/s41586-023-06801-2
研究者表示,这是一项意想不到的研究结果,因为在该研究之前,TAF15并不被认为会在神经变性疾病中形成淀粉样蛋白细丝结构,也并不存在这种蛋白质的结构;冷冻电镜技术如今正在广泛改变科学家们对痴呆症和神经变性疾病分子病理学的理解,这或许就为我们提供了超越以往技术能力的新见解。研究者Ryskeldi-Falcon补充道,运行冷冻电镜技术的技术挑战意味着我们只能观察四名个体的大脑,然而如今我们知道了关键蛋白质及其结构,我们也有潜力能开发新型工具,来在成百上千名患者样本中筛选这些异常的蛋白质聚集体,从而测试其运用的普遍程度。
一些额颞叶痴呆症患者往往患有运动神经元疾病,这是一种个体逐渐会丧失对肌肉控制的疾病,这项研究中,捐献大脑的两名个体就同时患有这两种疾病,对于这些个体而言,研究人员在其大脑区域中识别出了与运动神经元疾病相关的相同TAF15的聚集结构。研究者认为,两名患有额颞叶痴呆症和出现运动神经元疾病迹象的个体机体中存在相同的TAF15聚集体,这或许就增加了TAF15可能导致这两种疾病的可能性,目前研究人员正在研究未患额颞叶痴呆症的运动神经元疾病患者机体中是否存在异常的聚集TAF15蛋白。
综上,这项新研究识别出了与额颞叶痴呆症相关的特殊蛋白,从而就延续了研究人员通过冷冻电镜技术来阐明痴呆症相关蛋白质结构的成果,其中包括关键痴呆症蛋白tau的第一个结构,而知晓这种罕见的早发性痴呆症中这些纤维的特征和基本结构对于开发早期诊断测试和药物来抵御其形成或许至关重要;因此,TAF15淀粉样蛋白丝的结构或许为神经变性疾病模型系统的建立以及开发靶向作用TAF15蛋白疾病的新型诊断和治疗性工具提供了一定的基础。
原始出处:
Tetter, S., Arseni, D., Murzin, A.G. et al. TAF15 amyloid filaments in frontotemporal lobar degeneration. Nature (2023). doi:10.1038/s41586-023-06801-2
来源: 生物谷 公众号
( 转载文章系出于传递学术分享之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请通过 邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。)
2023-12-27 15:40:49 11563 浏览
近日,英国剑桥医学研究委员会(MRC)分子生物学实验室领导的研究团队发表在国际杂志Nature上题为“TAF15 amyloid filaments in frontotemporal lobar degeneration”的研究报告中,科学家们通过研究在额颞叶痴呆症病例中确定了蛋白质TAF15的聚集结构。
额颞叶痴呆是由大脑额叶和颞叶的退化所引起的,这两个大脑部位控制着机体的情绪、个性、行为以及言语和对词语的理解,其发病往往要比阿尔兹海默病更加年轻,通常会在45至65岁的人群中被诊断出来,尽管其还会影响年轻人和老年人。这项研究中,研究人员确定了一种特殊蛋白的聚集结构,这种蛋白质或有望未来帮助科学家们开发诊断测试技术和疗法。研究者Benjamin Ryskeldi-Falcon说道,这一研究发现或能改变我们对额颞叶痴呆症发病分子基础的理解,这是一项罕见的研究发现,研究人员发现了能在神经变性疾病中发生聚集的一小群蛋白质的新成员。
如今研究人员识别出了这种关键蛋白及其结构,他们就能开始针对这种类型的额颞叶痴呆进行诊断和治疗,类似于已经在开发的用于靶向作用β淀粉样蛋白聚集和tau蛋白聚集的策略,这些蛋白质是阿尔兹海默病发生的主要特征。如今科学家们使用先进的冷冻电镜技术能在院子分辨率下研究四名已患额颞叶痴呆症患者大脑中的蛋白质聚集物;长期以来,基于与其它神经变性疾病的相似性,在这种类型痴呆症的研究中,科学家们认为存在一种名为FUS的蛋白会发生聚集。而利用冷冻电镜技术,研究人员就能确定来自每个大脑组织中的蛋白聚集物或许具有相同的原子结构,而令人惊讶的是,这种蛋白质并不是FUS,而是另一种称之为TAF15的蛋白。

科学家识别出与人类额颞叶痴呆症发生相关的新型蛋白质。
图片来源:Nature (2023). DOI:10.1038/s41586-023-06801-2
研究者表示,这是一项意想不到的研究结果,因为在该研究之前,TAF15并不被认为会在神经变性疾病中形成淀粉样蛋白细丝结构,也并不存在这种蛋白质的结构;冷冻电镜技术如今正在广泛改变科学家们对痴呆症和神经变性疾病分子病理学的理解,这或许就为我们提供了超越以往技术能力的新见解。研究者Ryskeldi-Falcon补充道,运行冷冻电镜技术的技术挑战意味着我们只能观察四名个体的大脑,然而如今我们知道了关键蛋白质及其结构,我们也有潜力能开发新型工具,来在成百上千名患者样本中筛选这些异常的蛋白质聚集体,从而测试其运用的普遍程度。
一些额颞叶痴呆症患者往往患有运动神经元疾病,这是一种个体逐渐会丧失对肌肉控制的疾病,这项研究中,捐献大脑的两名个体就同时患有这两种疾病,对于这些个体而言,研究人员在其大脑区域中识别出了与运动神经元疾病相关的相同TAF15的聚集结构。研究者认为,两名患有额颞叶痴呆症和出现运动神经元疾病迹象的个体机体中存在相同的TAF15聚集体,这或许就增加了TAF15可能导致这两种疾病的可能性,目前研究人员正在研究未患额颞叶痴呆症的运动神经元疾病患者机体中是否存在异常的聚集TAF15蛋白。
综上,这项新研究识别出了与额颞叶痴呆症相关的特殊蛋白,从而就延续了研究人员通过冷冻电镜技术来阐明痴呆症相关蛋白质结构的成果,其中包括关键痴呆症蛋白tau的第一个结构,而知晓这种罕见的早发性痴呆症中这些纤维的特征和基本结构对于开发早期诊断测试和药物来抵御其形成或许至关重要;因此,TAF15淀粉样蛋白丝的结构或许为神经变性疾病模型系统的建立以及开发靶向作用TAF15蛋白疾病的新型诊断和治疗性工具提供了一定的基础。
原始出处:
Tetter, S., Arseni, D., Murzin, A.G. et al. TAF15 amyloid filaments in frontotemporal lobar degeneration. Nature (2023). doi:10.1038/s41586-023-06801-2
来源: 生物谷 公众号
( 转载文章系出于传递学术分享之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请通过 邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。)

 抢沙发,发首评,稳占C位!
立即抢沙发
抢沙发,发首评,稳占C位!
立即抢沙发




