TNF-α抑制剂治疗自身炎症性疾病的机制
+关注
1、TNF-α抑制剂的作用机制
TNF-α分为跨膜性(transmembrane TNF-α,tmTNF-α)和可溶性TNF-α(soluble TNF-α,sTNF-α),通过与肿瘤坏死因子受体(TNF receptor,TNFR)1结合,招募TNFR1相关的死亡结构域蛋白(TNFR1-associated death domain protein,TRADD),一方面激活半胱氨酸蛋白酶(caspase)8/9和混合系激酶区域样蛋白(mixed-lineage kinase domain-like protein,MLKL)参与细胞死亡,另一方面激活核因子κB(nuclear factor κB,NF-κB)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路介导炎症、细胞生存、增殖、免疫防御等。TNF-α与TNFR2结合则招募TNFR相关因子(TNFR-associated factor,TRAF),激活NF-κB,MAPK和蛋白激酶B通路(protein kinase B,PKB)介导细胞生存、增殖,组织再生等。tmTNF-α与TNF-α抑制剂或TNFR2结合可以诱导反向信号传导[2]。
目前用于临床的TNF-α抑制剂有依那西普,英夫利昔单抗,阿达木单抗,戈利木单抗,赛妥珠单抗。其作用机制主要分为两类:(1)中和TNF-α,阻断TNFR介导的效应;(2)主要由单克隆抗体类TNF-α抑制剂结合携带tmTNF-α的细胞,诱导反向信号传导和细胞毒作用(图1)[2]。
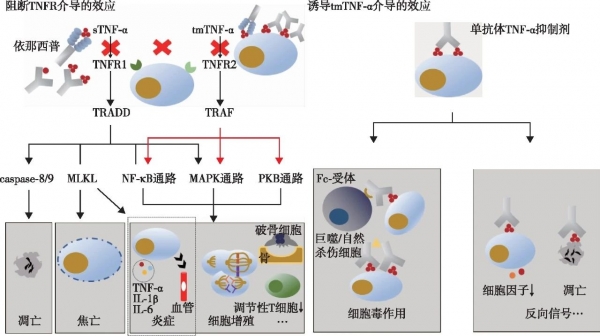
图1 TNF-α抑制剂的作用机制
2、TNF-α抑制剂治疗SAIDs的机制与进展
2.1 肿瘤坏死因子受体相关周期热综合征
肿瘤坏死因子受体相关周期热综合征(TNF receptor-associated periodic syndrome,TRAPS)是因肿瘤坏死因子受体超家族1A(TNF receptor superfamily member 1A,TNFRSF1A)基因突变引起TNFR1功能异常的常染色体显性遗传病。多在幼儿期发病,表现为反复发热、腹痛、肌痛、眶周水肿以及急性期反应物升高等,可导致淀粉样变[5]。TRAPS发病机制之一是TNFR从细胞膜表面脱落障碍,造成可溶性TNFR1(soluble TNFR1,sTNFR1)水平下降,削弱了其阻断TNF-α与TNFR1结合的作用,从而引起大量促炎因子激活TNFR1信号通路。研究发现TRAPS患者血清中sTNFR1水平下降,而依那西普可替代sTNFR1功能,因此是推荐用于治疗TRAPS的一线药物[6]。多项观察性研究证实依那西普可以有效改善TRAPS的症状,控制疾病活动[3]。依那西普也能改善TRAPS继发淀粉样变患者的肾功能并减少尿蛋白,防止淀粉样变复发[7]。
sTNF-α:可溶性肿瘤坏死因子-α;tmTNF-α:跨膜性肿瘤坏死因子-α;TNFR:肿瘤坏死因子受体;TRADD:肿瘤坏死因子受体1相关死亡结构域蛋白;TRAF:肿瘤坏死因子受体相关因子;caspase:半胱氨酸蛋白酶;MLKL:混合系激酶区域样蛋白;NF-κB:核因子κB;MAPK:丝裂原活化蛋白激酶;PKB:蛋白激酶B通路;IL-1β:白介素1β;IL-6:白介素6;C1q:补体成分C1q;↓表示减少
有趣的是,英夫利昔单抗用于TRAPS通常无效,甚至可能加重某些TRAPS患者的炎症,有研究发现使用英夫利昔单抗后,携带TNFRSF1A T50M变异的TRAPS患者外周血单个核细胞(pe**heral blood mononuclear cells,PBMCs)抗凋亡c-Rel活性增强,白细胞介素(interleukin,IL)-1β、IL-1受体、IL-6、IL-8和IL-12释放增加,同时抗炎IL-4和促凋亡IL-7水平降低[8]。因此不推荐英夫利昔单抗用于治疗TRAPS。阿达木单抗作为与英夫利昔单抗同样的单抗类TNF-α抑制剂,虽然有报道用于治疗TRAPS患者的葡萄膜炎,但同样不推荐用于治疗TRAPS[9]。三种TNF-α抑制剂的疗效差异原因尚不清楚,可能与不同的药代动力学特点有关,但有研究称三者结合TNF和补体激活的特性十分相似,疗效的不同不能用TNF内在结合特性或补体激活的差异来解释[10]。
2.2 腺苷酸脱氨酶2缺陷症
腺苷酸脱氨酶2缺陷症(adenosine deaminase 2 deficiency,DADA2)是由于腺苷酸脱氨酶2(adenosine deaminase 2,ADA2)基因变异引起ADA2蛋白缺乏的常染色体隐性遗传病。儿童发病常见,临床表现类似结节性多动脉炎,还可出现血液系统受累和免疫缺陷,如纯红再障、骨髓衰竭和淋巴增殖性疾病等。DADA2特征性的表现是早发卒中,可造成**残疾[11]。ADA2主要由单核/巨噬细胞表达,催化腺苷脱氨为肌苷,影响内皮细胞和造血细胞的发育,诱导单核细胞增殖和巨噬细胞分化。Zhou等[12]提出ADA2缺乏使单核细胞和巨噬细胞向促炎M1型分化,而抗炎M2型巨噬细胞分化不良,从而引起TNF-α、IL-6分泌和内皮损伤。Carmona-River等[13]发现ADA2缺乏引起腺苷累积,主要通过结合中性粒细胞上的A1腺苷受体(adenosine receptor),诱导中性粒细胞胞外陷阱增强,并驱动M1巨噬细胞生成TNF-α增加。DADA2患者皮肤组织和血浆中TNF-α水平升高,单细胞测序中TNFR1和TNFR2诱导的NF-κB信号通路基因表达上调[14]。以上研究均提示TNF-α是DADA2发病机制中重要的细胞因子。有研究发现经TNF-α抑制剂治疗后,DADA2患者全血基因表达谱和RNA测序中NF-κB和干扰素通路水平显著下降,肺、脑,皮肤组织的免疫染色显示血管内皮层完整,管周TNF-α减少,炎性髓细胞浸润消退,说明TNF-α抑制剂不仅可以在转录水平上显著改善炎症,也能恢复血管内皮的完整性。此外,在M2分化实验中,接受TNF-α抑制剂后,M2巨噬细胞细胞形态改善,数量显著增加,这表明TNF-α抑制剂改善了DADA2患者M2巨噬细胞分化障碍,恢复了失调的M1/M2巨噬细胞分化[15]。2021年一项单中心队列研究发现TNF-α抑制剂可以显著降低DADA2患者卒中发生率和炎症指标、改善肝脏受累表现,但对雷诺现象效果不佳,对血液病和免疫缺陷表型的疗效不一,总体耐受性良好[16]。最近1年以来的多项研究也证实TNF-α抑制剂可以降低DADA2患者的卒中风险并改善全身炎症[17],但随着时间增长,可能因产生抗TNF-α抑制剂的抗体而造成疗效不佳,症状加重,此时转换TNF-α抑制剂种类可能有用。
2.3 A20单倍体不足
A20单倍体不足(haploinsufficiency of A20,HA20)是由于TNF-α诱导蛋白3(TNF alpha induced protein 3,TNFAIP3)基因变异引起A20蛋白不足的常染色体显性遗传病,以反复发热、口腔、生殖器和/或胃肠道溃疡为主要表现,可并发如系统性红斑狼疮、自身免疫性甲状腺疾病等自身免疫性疾病[18]。A20既发挥去泛素化作用,通过卵巢肿瘤结构域移除κB抑制因子激酶γ、受体相互作用蛋白1和TRAF6上的赖氨酸63(K63)连接泛素链;又发挥泛素化作用,通过锌指4结构域介导E3泛素连接酶活性支持K48多泛素链的多聚泛素化,通过锌指7区域与线性多泛素链的结合抑制线性泛素链组装复合物介导的NK-κB信号[19-20]。A20是NF-κB信号通路和NLRP3炎性小体的负性调控因子,A20缺乏使NF-κB信号通路负性调控减弱和NLRP3炎性小体激活,引起IL-1β、IL-6、IL-18和TNF-α大量释放,多种淋巴细胞系分化和活化[21-22]。HA20患者血清和PBMCs刺激后上清中TNF-α水平显著升高,表明TNF-α可能是HA20的治疗靶点。据报道,英夫利昔单抗和依那西普能有效控制HA20全身炎症[23-24]。英夫利昔单抗、阿达木单抗联用其他免疫抑制剂能改善难治性、严重HA20患者的关节和肠道症状,使炎症指标恢复正常[25]。值得注意的是,重症HA20患者合并自身免疫性疾病可能同时出现自身炎症状态和自身抗体阳性,可能因为产生抗抗体而导致TNF-α抑制剂继发性无效[26]。
2.4 化脓性汗腺炎
化脓性汗腺炎(hidradenitis suppurativa,HS)是起源于毛囊的慢性、反复发作性自身炎症性皮肤病,表现为发生在腋窝、腹股沟、**生殖器周围的炎性结节、脓肿和窦道[27]。可能由于毛囊周围固有免疫系统异常激活导致滤泡上皮过度角化增生,扩大的毛囊破裂引起大量中性粒细胞、巨噬细胞、辅助性T细胞(T helper cell,Th)1、Th17细胞浸润和大量IL-1、IL-17和TNF-α释放,HS患者皮损中的TNF-α浓度较正常人明显升高[28-29]。阿达木单抗是唯一被欧洲药品管理局以及美国食品和药品管理局批准治疗中至重度HS的药物,在体外试验中能显著下调HS患者皮损IL-1β、IL-8、抗菌肽mRNA表达,抑制TNF-α释放[30],可能通过影响TNF-α继而下调抗凋亡作用的B细胞淋巴瘤/白血病-2(B-cell lymphoma-2,BCL-2)表达[31]。通过流式细胞术发现抗TNF治疗显著降低HS病灶及周围皮肤的Th17细胞和病灶的IL-17+CD4 T细胞频率,而调节性T细胞(regulatory T cells,Treg)细胞频率未见明显变化,表明TNF-α抑制剂能纠正Th17:Treg细胞失调,改善免疫调节,且治疗后病灶、周围皮肤和未受累皮肤中不产生细胞因子的CD4 +T细胞比例升高,而T细胞绝对数量没有减少,表明TNF-α抑制剂能改变HS患者CD4+T细胞产生细胞因子的功能[32]。阿达木单抗较依那西普和赛妥珠单抗能更有效抑制炎性巨噬细胞的分化,在转录谱上表现出独特的促伤口愈合的特征,如抑制基质金属蛋白酶(matrix metalloproteinase,MMP)通路、促进IL-10信号、缺氧诱导因子1a信号和巨噬细胞Fcγ受体介导的吞噬作用,还能显著降低外周血炎性MMP-1和MMP-9,升高促愈合的MMP-13和金属蛋白酶组织抑制剂2,以上表明阿达木单抗能差异性调节MMP表达,诱导其向促伤口愈合的形态转变[33]。一项3期开放标签扩展研究发现每周接受阿达木单抗治疗的中重度HS患者在长达168周内仍有52.3%可维持病情平稳[4]。单中心随机对照研究证实英夫利昔单抗治疗中重度HS患者有效[34]。依那西普和赛妥珠单抗不推荐用于HS患者。
2.5 其他SAIDs
一些SAIDs患者体内TNF-α升高,使用TNF-α抑制剂有效。部分慢性无菌性骨髓炎(chronic non-bacterial osteomyelitis,CNO)患者治疗有效[35]。TNF-α抑制剂联合其它免疫抑制剂、异维甲酸等能有效治疗化脓性关节炎、坏疽性脓皮病和痤疮(pyogenic arthritis,pyoderma gangrenosum,and acne,PAPA)综合征[36]。对IL-1抑制剂疗效不佳或者无法获得IL-1抑制剂的NLRP3相关自身炎症性疾病(NLRP3-associated autoinflammatory disease,NLRP3-AID)患者,TNF-α抑制剂也可以作为备选方案[37]。
3、总结与展望
TNF-α在SAIDs发病中发挥重要作用,TNF-α抑制剂可能通过中和TNF-α、调节巨噬细胞、T细胞功能等机制控制炎症,改善症状,成为许多SAIDs的治疗选择(表1)。但其治疗SAIDs的机制尚未完全阐明,仍面临如何解释TNF-α抑制剂之间的疗效差异、何时启用TNF-α抑制剂等临床问题。
表1 TNF-α抑制剂治疗SAIDs的机制

SAIDs:自身炎症性疾病;TRAPS:肿瘤坏死因子受体相关周期热综合征;DADA2:腺苷酸脱氨酶2缺陷症;HA20:A20单倍体不足;HS:化脓性汗腺炎;CNO:慢性无菌性骨髓炎;PAPA:化脓性关节炎、坏疽性脓皮病和痤疮综合征;NLRP3-AID:核苷酸结合寡聚化结构域样受体蛋白3相关的自身炎症性疾病;BCL-2:B细胞淋巴瘤/白血病-2;Th17:辅助性T细胞17;MMP:基质金属蛋白酶
。
参考文献:略
作者单位:100730 北京,中国医学科学院 北京协和医学院 北京协和医院风湿免疫科,风湿免疫病学教育部重点实验室,疑难重症及罕见病国家重点实验室,国家皮肤与免疫疾病临床医学研究中心
作者:张婧元,沈敏
来源:中华临床免疫和变态反应杂志 公众号
( 转载文章系出于传递学术分享之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请通过 邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。)
2023-12-12 16:03:08 12210 浏览
TNF-α分为跨膜性(transmembrane TNF-α,tmTNF-α)和可溶性TNF-α(soluble TNF-α,sTNF-α),通过与肿瘤坏死因子受体(TNF receptor,TNFR)1结合,招募TNFR1相关的死亡结构域蛋白(TNFR1-associated death domain protein,TRADD),一方面激活半胱氨酸蛋白酶(caspase)8/9和混合系激酶区域样蛋白(mixed-lineage kinase domain-like protein,MLKL)参与细胞死亡,另一方面激活核因子κB(nuclear factor κB,NF-κB)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路介导炎症、细胞生存、增殖、免疫防御等。TNF-α与TNFR2结合则招募TNFR相关因子(TNFR-associated factor,TRAF),激活NF-κB,MAPK和蛋白激酶B通路(protein kinase B,PKB)介导细胞生存、增殖,组织再生等。tmTNF-α与TNF-α抑制剂或TNFR2结合可以诱导反向信号传导[2]。
目前用于临床的TNF-α抑制剂有依那西普,英夫利昔单抗,阿达木单抗,戈利木单抗,赛妥珠单抗。其作用机制主要分为两类:(1)中和TNF-α,阻断TNFR介导的效应;(2)主要由单克隆抗体类TNF-α抑制剂结合携带tmTNF-α的细胞,诱导反向信号传导和细胞毒作用(图1)[2]。

图1 TNF-α抑制剂的作用机制
2、TNF-α抑制剂治疗SAIDs的机制与进展
2.1 肿瘤坏死因子受体相关周期热综合征
肿瘤坏死因子受体相关周期热综合征(TNF receptor-associated periodic syndrome,TRAPS)是因肿瘤坏死因子受体超家族1A(TNF receptor superfamily member 1A,TNFRSF1A)基因突变引起TNFR1功能异常的常染色体显性遗传病。多在幼儿期发病,表现为反复发热、腹痛、肌痛、眶周水肿以及急性期反应物升高等,可导致淀粉样变[5]。TRAPS发病机制之一是TNFR从细胞膜表面脱落障碍,造成可溶性TNFR1(soluble TNFR1,sTNFR1)水平下降,削弱了其阻断TNF-α与TNFR1结合的作用,从而引起大量促炎因子激活TNFR1信号通路。研究发现TRAPS患者血清中sTNFR1水平下降,而依那西普可替代sTNFR1功能,因此是推荐用于治疗TRAPS的一线药物[6]。多项观察性研究证实依那西普可以有效改善TRAPS的症状,控制疾病活动[3]。依那西普也能改善TRAPS继发淀粉样变患者的肾功能并减少尿蛋白,防止淀粉样变复发[7]。
sTNF-α:可溶性肿瘤坏死因子-α;tmTNF-α:跨膜性肿瘤坏死因子-α;TNFR:肿瘤坏死因子受体;TRADD:肿瘤坏死因子受体1相关死亡结构域蛋白;TRAF:肿瘤坏死因子受体相关因子;caspase:半胱氨酸蛋白酶;MLKL:混合系激酶区域样蛋白;NF-κB:核因子κB;MAPK:丝裂原活化蛋白激酶;PKB:蛋白激酶B通路;IL-1β:白介素1β;IL-6:白介素6;C1q:补体成分C1q;↓表示减少
有趣的是,英夫利昔单抗用于TRAPS通常无效,甚至可能加重某些TRAPS患者的炎症,有研究发现使用英夫利昔单抗后,携带TNFRSF1A T50M变异的TRAPS患者外周血单个核细胞(pe**heral blood mononuclear cells,PBMCs)抗凋亡c-Rel活性增强,白细胞介素(interleukin,IL)-1β、IL-1受体、IL-6、IL-8和IL-12释放增加,同时抗炎IL-4和促凋亡IL-7水平降低[8]。因此不推荐英夫利昔单抗用于治疗TRAPS。阿达木单抗作为与英夫利昔单抗同样的单抗类TNF-α抑制剂,虽然有报道用于治疗TRAPS患者的葡萄膜炎,但同样不推荐用于治疗TRAPS[9]。三种TNF-α抑制剂的疗效差异原因尚不清楚,可能与不同的药代动力学特点有关,但有研究称三者结合TNF和补体激活的特性十分相似,疗效的不同不能用TNF内在结合特性或补体激活的差异来解释[10]。
2.2 腺苷酸脱氨酶2缺陷症
腺苷酸脱氨酶2缺陷症(adenosine deaminase 2 deficiency,DADA2)是由于腺苷酸脱氨酶2(adenosine deaminase 2,ADA2)基因变异引起ADA2蛋白缺乏的常染色体隐性遗传病。儿童发病常见,临床表现类似结节性多动脉炎,还可出现血液系统受累和免疫缺陷,如纯红再障、骨髓衰竭和淋巴增殖性疾病等。DADA2特征性的表现是早发卒中,可造成**残疾[11]。ADA2主要由单核/巨噬细胞表达,催化腺苷脱氨为肌苷,影响内皮细胞和造血细胞的发育,诱导单核细胞增殖和巨噬细胞分化。Zhou等[12]提出ADA2缺乏使单核细胞和巨噬细胞向促炎M1型分化,而抗炎M2型巨噬细胞分化不良,从而引起TNF-α、IL-6分泌和内皮损伤。Carmona-River等[13]发现ADA2缺乏引起腺苷累积,主要通过结合中性粒细胞上的A1腺苷受体(adenosine receptor),诱导中性粒细胞胞外陷阱增强,并驱动M1巨噬细胞生成TNF-α增加。DADA2患者皮肤组织和血浆中TNF-α水平升高,单细胞测序中TNFR1和TNFR2诱导的NF-κB信号通路基因表达上调[14]。以上研究均提示TNF-α是DADA2发病机制中重要的细胞因子。有研究发现经TNF-α抑制剂治疗后,DADA2患者全血基因表达谱和RNA测序中NF-κB和干扰素通路水平显著下降,肺、脑,皮肤组织的免疫染色显示血管内皮层完整,管周TNF-α减少,炎性髓细胞浸润消退,说明TNF-α抑制剂不仅可以在转录水平上显著改善炎症,也能恢复血管内皮的完整性。此外,在M2分化实验中,接受TNF-α抑制剂后,M2巨噬细胞细胞形态改善,数量显著增加,这表明TNF-α抑制剂改善了DADA2患者M2巨噬细胞分化障碍,恢复了失调的M1/M2巨噬细胞分化[15]。2021年一项单中心队列研究发现TNF-α抑制剂可以显著降低DADA2患者卒中发生率和炎症指标、改善肝脏受累表现,但对雷诺现象效果不佳,对血液病和免疫缺陷表型的疗效不一,总体耐受性良好[16]。最近1年以来的多项研究也证实TNF-α抑制剂可以降低DADA2患者的卒中风险并改善全身炎症[17],但随着时间增长,可能因产生抗TNF-α抑制剂的抗体而造成疗效不佳,症状加重,此时转换TNF-α抑制剂种类可能有用。
2.3 A20单倍体不足
A20单倍体不足(haploinsufficiency of A20,HA20)是由于TNF-α诱导蛋白3(TNF alpha induced protein 3,TNFAIP3)基因变异引起A20蛋白不足的常染色体显性遗传病,以反复发热、口腔、生殖器和/或胃肠道溃疡为主要表现,可并发如系统性红斑狼疮、自身免疫性甲状腺疾病等自身免疫性疾病[18]。A20既发挥去泛素化作用,通过卵巢肿瘤结构域移除κB抑制因子激酶γ、受体相互作用蛋白1和TRAF6上的赖氨酸63(K63)连接泛素链;又发挥泛素化作用,通过锌指4结构域介导E3泛素连接酶活性支持K48多泛素链的多聚泛素化,通过锌指7区域与线性多泛素链的结合抑制线性泛素链组装复合物介导的NK-κB信号[19-20]。A20是NF-κB信号通路和NLRP3炎性小体的负性调控因子,A20缺乏使NF-κB信号通路负性调控减弱和NLRP3炎性小体激活,引起IL-1β、IL-6、IL-18和TNF-α大量释放,多种淋巴细胞系分化和活化[21-22]。HA20患者血清和PBMCs刺激后上清中TNF-α水平显著升高,表明TNF-α可能是HA20的治疗靶点。据报道,英夫利昔单抗和依那西普能有效控制HA20全身炎症[23-24]。英夫利昔单抗、阿达木单抗联用其他免疫抑制剂能改善难治性、严重HA20患者的关节和肠道症状,使炎症指标恢复正常[25]。值得注意的是,重症HA20患者合并自身免疫性疾病可能同时出现自身炎症状态和自身抗体阳性,可能因为产生抗抗体而导致TNF-α抑制剂继发性无效[26]。
2.4 化脓性汗腺炎
化脓性汗腺炎(hidradenitis suppurativa,HS)是起源于毛囊的慢性、反复发作性自身炎症性皮肤病,表现为发生在腋窝、腹股沟、**生殖器周围的炎性结节、脓肿和窦道[27]。可能由于毛囊周围固有免疫系统异常激活导致滤泡上皮过度角化增生,扩大的毛囊破裂引起大量中性粒细胞、巨噬细胞、辅助性T细胞(T helper cell,Th)1、Th17细胞浸润和大量IL-1、IL-17和TNF-α释放,HS患者皮损中的TNF-α浓度较正常人明显升高[28-29]。阿达木单抗是唯一被欧洲药品管理局以及美国食品和药品管理局批准治疗中至重度HS的药物,在体外试验中能显著下调HS患者皮损IL-1β、IL-8、抗菌肽mRNA表达,抑制TNF-α释放[30],可能通过影响TNF-α继而下调抗凋亡作用的B细胞淋巴瘤/白血病-2(B-cell lymphoma-2,BCL-2)表达[31]。通过流式细胞术发现抗TNF治疗显著降低HS病灶及周围皮肤的Th17细胞和病灶的IL-17+CD4 T细胞频率,而调节性T细胞(regulatory T cells,Treg)细胞频率未见明显变化,表明TNF-α抑制剂能纠正Th17:Treg细胞失调,改善免疫调节,且治疗后病灶、周围皮肤和未受累皮肤中不产生细胞因子的CD4 +T细胞比例升高,而T细胞绝对数量没有减少,表明TNF-α抑制剂能改变HS患者CD4+T细胞产生细胞因子的功能[32]。阿达木单抗较依那西普和赛妥珠单抗能更有效抑制炎性巨噬细胞的分化,在转录谱上表现出独特的促伤口愈合的特征,如抑制基质金属蛋白酶(matrix metalloproteinase,MMP)通路、促进IL-10信号、缺氧诱导因子1a信号和巨噬细胞Fcγ受体介导的吞噬作用,还能显著降低外周血炎性MMP-1和MMP-9,升高促愈合的MMP-13和金属蛋白酶组织抑制剂2,以上表明阿达木单抗能差异性调节MMP表达,诱导其向促伤口愈合的形态转变[33]。一项3期开放标签扩展研究发现每周接受阿达木单抗治疗的中重度HS患者在长达168周内仍有52.3%可维持病情平稳[4]。单中心随机对照研究证实英夫利昔单抗治疗中重度HS患者有效[34]。依那西普和赛妥珠单抗不推荐用于HS患者。
2.5 其他SAIDs
一些SAIDs患者体内TNF-α升高,使用TNF-α抑制剂有效。部分慢性无菌性骨髓炎(chronic non-bacterial osteomyelitis,CNO)患者治疗有效[35]。TNF-α抑制剂联合其它免疫抑制剂、异维甲酸等能有效治疗化脓性关节炎、坏疽性脓皮病和痤疮(pyogenic arthritis,pyoderma gangrenosum,and acne,PAPA)综合征[36]。对IL-1抑制剂疗效不佳或者无法获得IL-1抑制剂的NLRP3相关自身炎症性疾病(NLRP3-associated autoinflammatory disease,NLRP3-AID)患者,TNF-α抑制剂也可以作为备选方案[37]。
3、总结与展望
TNF-α在SAIDs发病中发挥重要作用,TNF-α抑制剂可能通过中和TNF-α、调节巨噬细胞、T细胞功能等机制控制炎症,改善症状,成为许多SAIDs的治疗选择(表1)。但其治疗SAIDs的机制尚未完全阐明,仍面临如何解释TNF-α抑制剂之间的疗效差异、何时启用TNF-α抑制剂等临床问题。
表1 TNF-α抑制剂治疗SAIDs的机制

SAIDs:自身炎症性疾病;TRAPS:肿瘤坏死因子受体相关周期热综合征;DADA2:腺苷酸脱氨酶2缺陷症;HA20:A20单倍体不足;HS:化脓性汗腺炎;CNO:慢性无菌性骨髓炎;PAPA:化脓性关节炎、坏疽性脓皮病和痤疮综合征;NLRP3-AID:核苷酸结合寡聚化结构域样受体蛋白3相关的自身炎症性疾病;BCL-2:B细胞淋巴瘤/白血病-2;Th17:辅助性T细胞17;MMP:基质金属蛋白酶
。
参考文献:略
作者单位:100730 北京,中国医学科学院 北京协和医学院 北京协和医院风湿免疫科,风湿免疫病学教育部重点实验室,疑难重症及罕见病国家重点实验室,国家皮肤与免疫疾病临床医学研究中心
作者:张婧元,沈敏
来源:中华临床免疫和变态反应杂志 公众号
( 转载文章系出于传递学术分享之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请通过 邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。)

 抢沙发,发首评,稳占C位!
立即抢沙发
抢沙发,发首评,稳占C位!
立即抢沙发




