文献速递|自身免疫性肾脏疾病和移植中的调节性T细胞
+关注
一、前言
表达转录因子叉头盒蛋白P3(FOXP3)的调节性T(Treg)细胞自然存在于免疫系统中,并在维持免疫自我耐受、免疫系统和组织稳态中发挥作用。Treg细胞通过多种机制抑制T细胞的活化、扩增和载体功能,特别是通过控制抗原提呈细胞的功能来抑制T细胞。它们还可以通过抑制炎症和促进组织再生来促进组织修复。Treg细胞的单基因异常和Treg细胞功能分子的遗传变异可导致或促使患者发展为自身免疫性疾病和其他炎症性疾病,包括肾脏疾病。
Treg细胞可以用于靶向治疗免疫疾病并建立移植耐受,例如,通过使用IL-2或小分子在体内扩增天然Treg细胞,或在体外扩增用于进行Treg细胞治疗。研究者也在努力将抗原特异性的常规T细胞转化为Treg细胞并生成嵌合抗原受体Treg细胞。
来自日本大阪大学的Mikami N和东京大学的Sakaguchi S在这篇综述中描述了对nTreg(tTreg和pTreg)和iTreg细胞发育和功能的细胞和分子基础的理解及进展。基于基础Treg细胞研究的发现,讨论了nTreg细胞发育或功能的分子异常如何导致自身免疫性疾病和其他炎症性疾病的发生,包括自身免疫性肾脏疾病。这篇综述还讨论了如何利用nTreg细胞和iTreg细胞来治疗肾脏疾病和诱导免疫耐受,特别是在肾移植的情况下。
二、调节性T细胞的背景介绍
调节性T(Treg)细胞是一种独特的CD4+ T细胞亚群,自然存在于免疫系统中,进行免疫抑制。这些细胞特异性表达转录因子叉头盒蛋白P3(FOXP3),并表达高亲和力的IL-2受体,CD25以及共抑制受体细胞毒性T淋巴细胞抗原4(CTLA4)作为受体的组成部分。
自然产生的FOXP3+ CD25+ CTLA4+ CD4+ Treg(称为nTreg)细胞对于维持免疫自我耐受和稳态是不可或缺的。在正常啮齿动物中,当CD25+ CD4+ T细胞被移除时,就会发生自身免疫性疾病,如T1DM、自身免疫性甲状腺炎和胃炎;这些疾病可以通过重建CD25+ CD4+ Treg细胞来预防。此外,FOXP3突变会导致人类和啮齿动物的先天性Treg细胞缺陷,从而导致IPEX(免疫缺陷、多内分泌病、肠病、x-连锁)综合征。
鉴于Treg细胞在免疫耐受和稳态中不可或缺的作用,它们可以在临床环境中靶向控制生理和病理免疫反应。例如,在肿瘤宿主中消耗Treg细胞可以唤起和增强抗肿瘤免疫,而Treg细胞扩增在治疗自身免疫性和炎症性疾病以及建立异体器官移植的免疫耐受方面发挥重要作用。
大多数FOXP3+ Treg细胞是由胸腺产生的,作为一个功能独特且成熟的群体。这些胸腺来源的Treg(称为tTreg)细胞功能稳定,并具有广泛的抗原特异性。一些T细胞在周围分化为Treg细胞,特别是在肠黏膜中。这些外周来源的Treg(称为pTreg)细胞也功能稳定,但其抗原特异性有限。常规T细胞也可以在体外诱导Treg细胞。然而,这些诱导的Treg(称为iTreg)细胞功能不稳定,抗原特异性有限。为了治疗,研究者努力在体内和体外扩增nTreg细胞,保留其抑制功能,并产生具有特定抗原特异性的功能稳定的iTreg细胞(图1)。
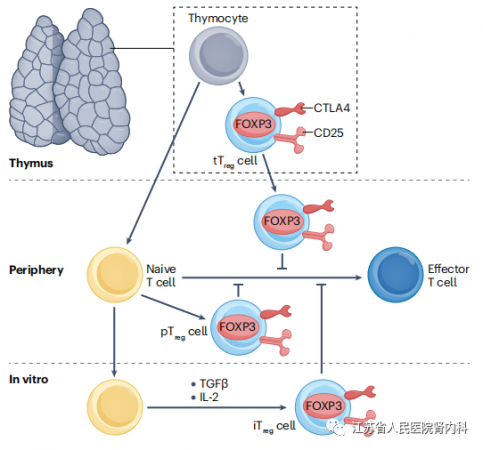
图1 .FOXP3+ Treg细胞。调节性T细胞(Treg)是一种独特的CD4+ T细胞群体,它可以抑制其他免疫细胞的功能,特别是效应T细胞。除了转录因子FOXP3的表达外,Treg细胞还在其细胞表面构成性表达CD25和CTLA4。
三、Treg细胞的发展和功能
Treg细胞在胸腺内分化为成熟的具有不同功能的抗原特异性抑制T细胞。相比之下,传统T(Tconv)细胞在外周受到抗原刺激并分化为抗原特异性效应T细胞之前,它们在功能上是幼稚的。在胸腺中,发育中的对自肽-mhc配体有中度亲和力的T细胞驱动发育为Treg细胞,而低度亲和力的发育为幼稚Tconv,高亲和力的被去除。因此,tTreg细胞具有与Tconv细胞一样广泛的TCR库,但倾向于识别胸腺自肽-MHC配体,比被相同配体选择的Tconv细胞具有更高的亲和力。
在与自身肽-mhc配体相互作用后,发育中的胸腺Treg(tTreg)细胞中的TCR信号激活Treg特异性增强子,特别是Treg特异性超级增强子(Treg-SEs)(由H3K27组蛋白乙酰化程度定义),这些基因与Treg特征基因如Foxp3、Il2ra和Ctla4相关。Treg-SEs的激活诱导了这些基因的表达,从而决定了tTreg细胞的身份。
1.Treg细胞的稳定性和表观遗传学
天然Treg(nTreg)细胞功能稳定,在各种动物模型中,nTreg细胞的采用过继性转移可以实现长期抑制自身免疫性疾病的发展,而nTreg细胞的消耗可以在生命的任何阶段诱发自身免疫性疾病。tTreg细胞不仅在TCR库中存在自倾斜,而且处于抗原引物状态(通过T细胞辅助分子如粘附分子的高表达得到证明),并具有foxp3依赖的TCR近端信号控制。这些Treg细胞的特性,连同它们的高IL-2敏感性,使它们能够快速和强烈激活,在抗原识别时扩展,确保它们在炎症部位对Tconv细胞的显性抑制。
在生理条件下,一些效应型nTreg细胞处于活跃的增殖状态,可能是因为它们已经识别了自身抗原或可能来自共生微生物的抗原。特别是DNA甲基化和去甲基化,稳定地通过细胞分裂遗传,有助于细胞谱系连续性tTreg细胞从胸腺到外围稳定Treg特异性基因表达,因此使这些细胞维持免疫自我耐受和稳态。nTreg细胞在Treg特征基因位点(如Foxp3、Il2ra和Ctla4)上获得了一种独特的DNA低甲基化模式,而这种模式在幼稚或激活的Tconv细胞或其他免疫细胞中没有发现。
2.周围nTreg细胞的存活需要IL-2
周围nTreg细胞的存活和功能维持需要TCR刺激和IL-2。IL-2的缺乏和高亲和力的IL-2受体表达的独特组合是Treg细胞的一个基本特征。FOXP3在TCR刺激下抑制IL-2的转录,而IL2RA基因位点的Treg-SE有助于高亲和力IL-2受体的特异性表达,该受体与外源性IL-2结合。因此,Treg细胞的生存高度依赖于外源IL-2。短期给予抗IL-2中和性单克隆抗体(mAb)可显著减少Treg细胞的数量,抑制其在识别自身抗原时的增殖,从而导致自身免疫性疾病的发展。
3.Treg细胞在维持组织稳态中的作用
在生理条件下,效应型Treg细胞迁移并驻留在器官和组织中,如皮肤、肺、肠和脂肪组织,以积极维持局部组织稳态。这些Treg细胞具有组织特异性的表型,表达特定的趋化因子受体。CCR4的缺乏会阻止Treg细胞在皮肤和肺中的生理积累,从而导致这些器官的炎症。
此外,Treg细胞和效应Tconv细胞被招募到炎症的特定组织部位,表现出类似的转录因子和趋化因子受体表达模式。例如,Treg细胞1型炎症表达T-bet和CXCR3,2型炎症表达GATA3,CCR4和/或CCR8,和3型炎症表达CCR6 RORγt,这分别与T辅助1(TH1)细胞,T辅助2(TH2)细胞和T辅助17(TH17)细胞一样。Treg细胞不仅通过抑制炎症,还通过积极促进进组织再生,例如,通过产生生长因子双向调节蛋白。
综上所述,Treg细胞通过抑制炎症和促进组织干细胞的分化和增殖来调节局部组织环境,从而发挥作用。
4.Treg细胞的抑制功能
FOXP3+ Treg细胞通过细胞接触依赖和体液因子介导的机制,包括细胞表面分子(CTLA4、CD25、TIGIT、CD39和CD73)、细胞因子(IL-2、IL-10、TGFβ和IL-35),以及分泌的或细胞内的分子(颗粒酶、cAMP和IDO)。FOXP3的异位表达可以抑制Tconv细胞活性,这表明FOXP3作为一些基因的抑制因子,或作为其他基因的激活因子,控制着Treg签名分子(s)介导的Treg细胞介导的抑制的表达。敲除Il2、Il2ra或Il2rb的小鼠会发生类似于FOXP3突变体或缺陷小鼠的致命的自身免疫性疾病,可能是由于Treg细胞存活率降低。
CTeg细胞特异性缺乏CTLA4会产生严重的自身免疫性疾病,而Treg细胞特异性IL-10缺乏会引起结肠炎和肺炎,但不会引起自身免疫性疾病。
Treg细胞特异性缺陷导致自身免疫性疾病。比如FOXP3缺陷,该分子具有Treg细胞特异性基因调控,确保其在Treg细胞中高/持续表达,抑制Treg细胞耗尽产生的自身免疫性疾病。在Treg细胞激活剂上共刺激信号,比效应Tconv细胞的功能更强。抗原激活的Treg细胞与抗原呈递细胞(APC)在有限时间内相互作用,通过决定应答T细胞的细胞命运(凋亡细胞死亡、无反应性或休眠),实现长期的免疫抑制和耐受(图2)。
CTLA4依赖的APCs抑制是Treg细胞介导的免疫抑制的潜在核心机制;然而,上面讨论的其他分子和机制可以根据组织位置、炎症类型和强度在不同程度上增强Treg细胞介导的免疫抑制。
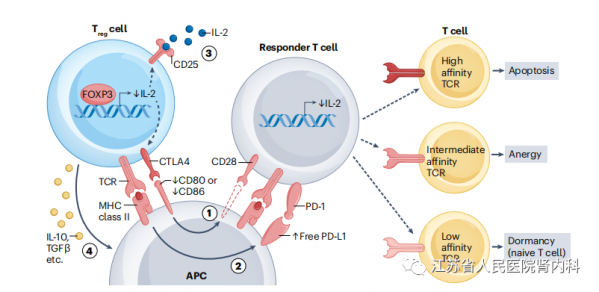
图2 | Treg细胞介导的免疫抑制和诱导长期耐受。调节性T(Treg)细胞组成性表达CTLA4和CD25,并在T细胞受体(TCR)刺激下上调这些受体的表达(步骤1)。TCR刺激激活后,Treg细胞通过CTLA4依赖的滋养细胞作用和随后的反内吞作用下调抗原提呈细胞(APCs)上CD80和CD86的表达,从而降低了应答T细胞的共刺激分子的可用性(步骤2)。这种自由的PD-L1可以与表达PD1的效应T细胞相互作用,抑制它们的激活和效应功能(步骤3)。Treg细胞也表达高亲和力的IL-2受体,并从周围环境中吸收IL-2,从而剥夺应答T细胞的IL-2,并可能有助于抑制它们。
5.人Treg细胞亚群
人循环中的FOXP3+ T细胞可以高度富集为CD127(也称为IL-7受体亚基-α)阴性的CD4+ T细胞。然而,一些活化的CD127lowCD4+ Tconv细胞也表达FOXP3,尽管其表达水平较低,体外抑制活也更低。健康个体循环的FOXP3+ CD4+ T细胞根据其FOXP3和CD45RA的表达可分为三个部分。组分I(FrI)CD45RA+FOXP3lowCD25低幼稚或静息调节T(Treg)细胞包括最近的胸腺迁移,并在TCR刺激下分化为组分II(FrII)CD45RA?FOXP3hiCD25hi效应Treg细胞。Fr II细胞表达高水平的CTLA4,具有高度增殖性和强抑制性,并具有Treg细胞型表观基因组。相比之下,大多数组分III(FrIII)CD45RA?FOXP3lowCD25低T细胞没有抑制作用。这部分主要包括活化的常规T(Tconv)细胞,包括各种辅助T细胞亚群,FOXP3表达不稳定。总之,人体FOXP3阳性的T细胞在功能、基因型和分化阶段上存在异质性,包括幼稚Treg细胞、效应Treg细胞和活化的Tconv细胞。这些亚型的改变可以反映免疫疾病的存在。
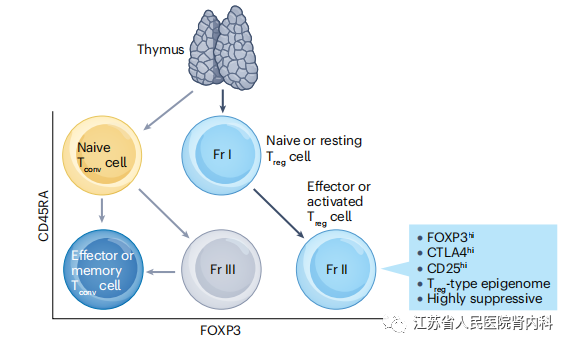
图3人FOXP3+ T细胞的亚群。
四、自身免疫性和炎症性疾病
中的Treg性细胞
1. 调节T细胞病
影响Treg细胞的单基因自身免疫性疾病或炎症性疾病被称为调节T细胞病(tregopathies)。IPEX综合征于1982年首次被描述为一种x-连锁免疫缺陷综合征,并伴有严重的自身免疫性疾病、T1DM、肠病和湿疹。除了这一典型的新生儿发病三联征外,IPEX综合征患者还会发生不同频率的自身免疫性疾病(如自身免疫性甲状腺炎、肾炎、关节炎、肝炎、溶血性贫血、血小板减少和脱发)。2000-2001年发表的研究确定了该疾病基因为FOXP3。迄今为止,在IPEX综合征患者中至少报道了70个FOXP3基因突变。这些突变取消了功能性FOXP3蛋白的表达,导致严重的临床表现。IPEX综合征提供了明确的证据,表明nTreg细胞的缺陷或功能障碍不仅可能是人类自身免疫性疾病的主要原因,也可能是人类炎症性肠病(IBD)和过敏的主要原因。这一综合征表明,人类Treg细胞在抑制对自身和非自身抗原的免疫反应方面发挥了作用。
其他和Treg细胞功能相关基因的突变也可导致严重的自身免疫疾病。比如编码CD25、CTLA4的IL2RA基因突变可发展为严重自身免疫疾病。可促进Treg细胞分化和Treg/Th17细胞平衡的BACH2和STAT3基因突变可导致肠病和其他免疫异常。DiGeorge(22q11.2缺失)综合征和Omenn综合征伴有严重的联合免疫缺陷和自身免疫也经常与胸腺和循环Treg细胞的减少有关。编码自身免疫调节因子(AIRE)的AIRE基因功能缺失突变导致自身免疫性多内分泌腺病-念珠菌病-外胚层营养不良(APECED)综合征,循环中幼稚Treg细胞数量减少。
2.多因素多基因自身免疫性疾病
全球有5~10%的人口都受到常见的多因素多基因自身免疫性疾病如T1DM,类风湿关节炎和系统性红斑狼疮的影响。器官特异性自身免疫性疾病患者中,组织炎症部分的FOXP3阳性T细胞数量增加,但外周血中的数量并不会改变。与免疫学方法相比,基因组分析可以为Treg细胞在自身免疫中的作用提供更可靠的线索。
全基因组关联研究(GWAS)发现,在常见的多基因自身免疫性疾病中,约有60%的因果单核苷酸多态性(SNPs)定位于免疫细胞的非编码增强子区域,特别是CD4+ T细胞。这表明与T细胞功能相关基因相关的自身免疫SNPs主要是影响Treg细胞的功能丧失变异,而不是影响自身免疫Tconv细胞的功能获得变异。许多自身免疫易感SNPs存在于Treg细胞功能相关基因的增强子区域,如IL2RA和CTLA4,可能作为控制内源性Treg细胞发育和功能的表达数量性状位点。
3.自身免疫性肾病
约30%的IPEX患者发展为自身免疫性肾脏疾病,如肾小球肾炎和膜性肾病,提示Treg细胞异常可能是这些疾病的主要原因。一些Treg细胞异常性疾病,如IPEX综合征,也显示肾脏中有炎症细胞浸润。通过全基因组关联研究(GWAS)发现的与Treg细胞发育和功能有关的自身免疫性单核苷酸多态性(SNPs)可能是系统性红斑狼疮(SLE)和IgA肾病的致病变异。许多报道也介绍了肾脏疾病患者循环Treg细胞数量的变化,但其病理性意义尚不清楚。
一项关于活动性SLE患者的研究报告称,Fr II效应Treg细胞的比例显着降低,而Fr I幼稚Treg细胞和特别是Fr III非Treg细胞的比例显着增加,与健康个体相比,这些结果表明激活的FOXP3+ T conv细胞(分泌促炎细胞因子)的数量增加。该研究中未报告狼疮肾炎患者的比例。然而约38%的SLE患者合并肾脏疾病。
Goodpasture病是由针对IV型胶原的CD4+ T细胞介导的,该T细胞攻击肾小球基底膜(GBM)。识别IV型胶原肽-MHC的Treg细胞在HLA-DR1等位基因起主要保护作用的人群以及同时表达保护性HLA-DR1和易感HLA-DR15等位基因的人群中显着增加。因此,HLA基因多态性在一定程度上通过影响自身抗原特异性Treg细胞的数量和谱系来参与疾病易感性的形成。
在老鼠中,CD25+CD4+ nTreg细胞的耗竭导致了各种自身免疫性疾病的发展。其中一些老鼠发展为肾小球肾炎,伴有免疫复合物沉积在肾小球毛细血管丛中。这种肾脏病变类似于狼疮肾炎,并且这些老鼠具有高滴度的IgG抗dsDNA和其他狼疮自身抗体。另一项研究发现,叶酸受体4(FR4)由nTreg细胞特别是活化的nTreg细胞特异性表达。给予抗FR4 mAb可使年轻老鼠的这些细胞耗竭,并导致器官特异性自身免疫性疾病的发展,包括严重的自身免疫性膀胱炎和输尿管炎,这些疾病伴有针对尿路上皮细胞的自身抗体,最终导致由于输尿管梗阻而引起的肾积水。
CD25+CD4+ nTreg细胞已被证明在各种模型中可以防止自身免疫性肾脏疾病的发展,包括狼疮易感的NZBxNZW F1小鼠的肾小球肾炎、由 pristane 诱导的狼疮肾炎、由抗GBM抗体诱导的肾小球肾炎、髓过氧化物酶抗中性粒细胞胞质抗体(MPO-ANCA)相关的肾小球肾炎以及由长期给予BSA和CCl4引起的大鼠的IgA肾病。Treg细胞的保护作用也已在急性肾损伤(AKI)的啮齿动物模型中得到证实,例如缺血再灌注损伤、顺铂肾毒性和败血症诱导的AKI,以及包括阿霉素肾病在内的慢性肾病模型中得到证实。此外,nTreg细胞的过继转移可以防止db/db小鼠模型中糖尿病肾病的发展。
在一些自身免疫性肾脏疾病中,如Goodpasture病和狼疮性肾炎,调节性T细胞似乎抑制TFH细胞和B细胞。在蛋白免疫接种的小鼠和自身抗体介导的关节炎模型(K/BxN小鼠)中,调节性T细胞的耗竭增加了TFH细胞和浆细胞的数量、生发中心的形成和抗体的产生。阻断CTLA4或特异性的调节性T细胞CTLA4基因敲除,导致生发中心对蛋白免疫接种的反应增强,伴TFH细胞、TFR细胞和浆细胞增多。在SLE患者中,TFH细胞的增加与自身抗体滴度和肾脏损伤程度相关,而TFR细胞与TFH细胞的比例与疾病活动性相关。这些研究表明,调节性T细胞(尤其是TFR细胞)是抑制抗体介导的自身免疫性肾脏所必需的。
现有数据表明,nTreg细胞的异常可能导致一些自身免疫性肾脏疾病,尽管免疫复合物性肾小球肾炎可能是由Treg细胞异常引发的系统性自身免疫反应所继发的。调节性T细胞也可以用于治疗动物模型中的自身免疫性肾脏疾病,通过直接抑制肾脏炎症或间接抑制系统性自身免疫炎症。
五、器官移植中的Treg细胞
FOXP3+ Treg细胞可以抑制参与移植排斥的免疫细胞,包括CD8+细胞毒性T细胞、TH1细胞、TH2细胞和TH17细胞,有助于细胞介导的移植排斥;TFH细胞和B细胞产生供体特异性抗体;树突状细胞和B细胞,通过直接和间接途径向T细胞呈现异体抗原。Treg细胞也能在实体器官移植中建立移植物耐受性,预防实验动物造血干细胞移植后的移植物抗宿主病(GVHD)。
1.移植耐受
CD25+CD4+nT-reg细胞在移植耐受中的作用首先是通过发现CD25+CCD4+nTreg细胞的耗竭不仅引起小鼠的自身免疫,而且加速小鼠的皮肤移植物排斥反应而提出的。随后在具有同种异体皮肤移植物的T细胞缺陷小鼠中的实验表明,在高Treg与Tconv细胞比率下,nT-reg细胞与Tconv细胞的共转移可以实现稳定的移植物耐受性;从已建立耐受性的小鼠过继转移Treg细胞可以将这种耐受性过继转移到正常小鼠;并且经过体外同种异体抗原刺激以诱导具有同种异体抗原特异性的那些细胞扩增的nTreg细胞比未刺激的nTreg细胞具有更有效的耐受诱导活性。类似地,来自具有移植物耐受性的小鼠的nTreg细胞,例如,通过用环孢素或细胞非消耗性抗CD4 mAb处理诱导的,可以过继转移这种耐受性。
在异基因混合淋巴细胞反应测定中,nTreg细胞以抗原特异性和剂量依赖性的方式抑制应答T细胞。此外,在高剂量IL-2存在下用同种抗原刺激的nTreg细胞显示出克隆扩增,并且在体内和体外表现出比未刺激的Treg细胞更强的同种抗原特异性抑制。这些发现表明,耐受诱导的功效取决于同种抗原特异性nTreg细胞的扩增及其对同种反应效应物Tconv细胞的显性抑制。
2.肾移植
一项在肾和骨髓联合移植(CKBMTs)受者中的研究表明了Treg细胞在人肾移植耐受中的作用,该研究显示在稳定耐受状态的异体肾移植中FOXP3 mRNA高水平表达。患者的TCR报告分析显示,肾移植耐受可归因于同种异体T细胞的缺失和供体特异性Treg细胞的富集。因此,Treg细胞特别是激活的效应型Treg细胞的扩增,可能是肾移植中稳定耐受的重要生物标志物。
六、Treg细胞疗法
FOXP3+ Treg细胞有可能作为抗原特异性的“活药物”,用于治疗自身免疫性疾病并诱导移植耐受(图4)。使用Treg细胞疗法可以规避与目前非抗原特异性免疫抑制疗法(如皮质类固醇、钙调神经磷酸酶抑制剂、抗t细胞血清和CTLA4-Ig相关的各种临床问题,包括由于长期使用而增加感染的可能性和药物毒性。
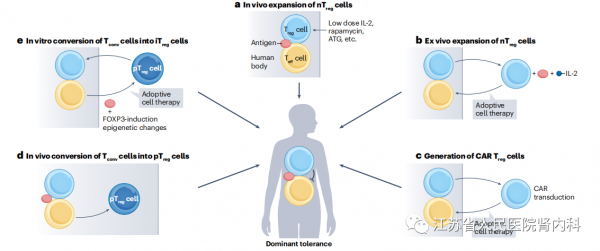
图4.在自身免疫性疾病或移植中建立Treg细胞介导的显性耐受的潜在方法。a,通过低剂量IL-2、抗胸腺细胞球蛋白(ATG)或雷帕霉素的治疗,自然调节性T(nTreg)细胞可以在体内以抗原特异性或非特异性(多克隆)的方式扩增。b,nTreg细胞也可以通过抗原和IL-2刺激在体外扩增,然后作为采用Treg细胞治疗。c,嵌合抗原受体(CAR)Treg细胞也可以通过工程CARs的转导由nTreg细胞产生,并用作采用的Treg细胞治疗。标准的CAR结构可以识别单个分子,而nTreg细胞可以通过它们的TCR识别广泛的抗原。d,常规T(Tconv)细胞也可以在体内转化为外周来源的Treg(pTreg)细胞,例如通过CDK8/19。e,体外诱导Tconv细胞转变为Treg(iTreg)细胞。这些方法可能会建立一种显性耐受状态,在这种状态下,Treg细胞能够抑制介导自身免疫性疾病或移植物排斥反应的效应T(Teff)细胞的功能。
1.体内nTreg细胞扩增
临床应用Treg细胞的方法主要是扩增生成功能性FOXP3+ nTreg细胞,并增强其抑制功能,特别是通过IL-2扩大Treg细胞和抑制TH17和TFH细胞的分化。低剂量的IL-2可以选择性地扩大Treg细胞,同时避免Tconv细胞的激活扩增和高剂量IL-2的严重副作用,因为Treg细胞构成表达高水平的高亲和力的IL-2受体,不产生IL-2和内在激活STAT5依赖信号通路。
低剂量IL-2也能诱导Treg细胞中抗凋亡的BCL-2的表达,并增强其在人体内的抑制功能。低剂量IL-2诱导Treg细胞扩增首次被证明有利于治疗丙型肝炎病毒诱导的血管炎和GVHD,随后被研究用于其他免疫性疾病的治疗,包括SLE和T1DM。
小分子也可以不同地控制Treg细胞和Tconv细胞,从而促进耐受性诱导。例如,TCR信号通过PI3K-AKT-mTOR通路调节nTreg细胞的发育,mTOR抑制剂雷帕霉素已被证明在体内和体外扩增nTreg细胞。该药物有可能在临床环境中用于扩增nTreg细胞。与接受钙调神经磷酸素抑制剂治疗的肾移植受者相比,接受雷帕霉素免疫抑制方案治疗的Treg细胞数量增加。在小鼠中,口服周期蛋白依赖性激酶8(CDK8)和CDK19的化学抑制剂,与中介复合物相关并调节基因转录,诱导抗刺激Tconv细胞中Foxp3的表达,将其转化为具有Treg型表观基因组的pTreg细胞,包括Foxp3 CNS2去甲基化。因此,靶向Foxp3诱导所需的细胞信号传递的小分子可能被用作新的免疫抑制疗法。
2. nTreg细胞疗法
另一种治疗自身免疫性疾病和预防移植物排斥反应的方法是采用Treg细胞治疗。目前大多数Treg细胞疗法是从患者的血液中纯化得到Treg细胞,然后通过抗cd3/CD28刺激在体外扩增,从而产生多克隆的Treg细胞群,或通过异基因刺激细胞的刺激,得到丰富的同种异体抗原特异性Treg细胞。自体nTreg细胞治疗的I期临床试验表明,该方法对T1DM患者和GVHD患者是安全的。转移的Treg细胞在转移1年后仍能在循环中检测到。在肾移植中,nTreg细胞治疗方法的应用也已在各种Treg细胞扩增方法的临床试验中进行了研究(表1)。
图片
表1 肾移植中Treg细胞疗法的临床试验
I期TRACT试验(NCT02145325)报道,在2年的随访中,体外输注多克隆扩增的自体Treg细胞增加了肾移植受者的循环Treg细胞水平,而没有任何不良事件,如排斥或感染。扩增的Treg细胞显示FOXP3 CNS2高度去甲基化。一项I/IIa期临床试验(NCT02371434)显示,在60周的研究期间,肾移植后7天输注多克隆扩增的自体nTreg细胞可使免疫抑制最小化;在接受Treg细胞治疗的患者中实现了单药免疫抑制,而参照组患者仍接受双重或三重免疫抑制治疗。在这项研究中,通过TCR序列分析证实了移植物特异性Treg细胞的扩增。另一项I期试验(NCT02129881)报道,与移植后48个月接受标准免疫抑制的患者相比,接受自体多克隆nTreg细胞注射的肾移植受者无排斥,生存得到改善。两项临床研究(NCT02244801和NCT02091232)已经研究了供体特异性nTreg细胞在肾移植中的应用。
开发更有效的nTreg细胞治疗方法的关键挑战是提高Treg细胞的纯度、抗原特异性、功能稳定性和存活率,特别是在体内转移后。虽然效应nTreg细胞在体内处于高度增殖状态,但体外TCR刺激主要使幼稚的nTreg细胞扩张,导致激活和促凋亡表型。这些被激活和扩张的Treg细胞中有相当一部分可能在转移后立即死亡,因为它们从体外高IL-2浓度环境转移到体内低IL-2环境。因此,IL-2给药可能有助于增加Treg细胞转移后的存活,而不将其转化为Tconv细胞。
3. iTreg细胞治疗
使用iTreg细胞的优势是CD4+ Tconv细胞通过体外抗原刺激TGFβ和IL-2容易制备大量的抗原iTreg细胞。然而,使用iTreg细胞的一个缺点是其功能不稳定。与nTreg细胞相比,iTreg细胞中Foxp3的表达是不稳定的,主要是由于Treg-DRs的不完全表观遗传变化,导致它们在某些体内条件下重新转化为效应T细胞。
通过安装nTreg型表观遗传变化,各种方法可以增加iTreg的稳定性。抗坏血酸(也被称为维生素C)作为10-11种易位(TET)酶的辅助因子,介导DNA去甲基化。在GVHD186-188小鼠模型中,抗坏血酸已被证明可以促进Foxp3 CNS2在小鼠iTreg细胞中的从头低甲基化,从而提高Foxp3表达的稳定性和这些细胞的抑制活性。据报道,一些小分子可以诱导Foxp3,包括雷帕霉素、维甲酸和丁酸,但它们都需要TGFβ在体外诱导Foxp3,在炎症条件下作用有限。
然而,使用这些方法结合剥夺CD28共刺激可能可以利用CRISPR-cas9介导的基因缺失进行基因组编辑,也可能被用于修饰对iTreg细胞生成和功能有利或不利的分子的表达。在未来,进一步的技术进步有望使抗原特异性iTreg细胞用于与nTreg细胞具有类似功能和稳定性的细胞治疗。
4. CAR Treg细胞疗法
在nTreg细胞或iTreg细胞中,通过转导工程TCR或嵌合抗原受体(CAR)可以有效地产生抗原特异性Treg细胞。CARs是由抗体的抗原结合区、TCR的胞内结构域和刺激分子如CD3、CD28和4-1BB(也称为TNFRSF9和CD137)组成的人工受体。在小鼠模型中,异性TCR转导或CAR转导的nTreg细胞在延长皮肤移植存活和抑制GVHD方面比对照nTreg细胞更有效。
一项首次在人的I/IIa期临床研究已经开始评估HLA-A2特异性CAR Treg细胞治疗活体供肾移植受者的安全性和耐受性。与nTreg细胞相比,使用CAR Treg细胞的一个优点是,前者可以通过在任何nTreg细胞中表达单一的CAR结构,具有MHC不受限制的生理TCR依赖抗原识别。然而,CAR结构中的抗体Fab部分将靶分子的识别限制在主要表达在靶细胞表面或炎症环境中的单个分子上,而nTreg细胞的TCR可以识别APCs呈递的任何抗原。目前正在努力识别被CAR识别的靶分子,以特异性激活CAR Treg细胞进行炎症特异性免疫抑制,并使用第三方Treg细胞或多能干细胞来源的Treg细胞制备“现成的”Treg细胞疗法。这些方法不仅可以提高治疗效果,而且还可以降低治疗的成本。
七、总结
nTreg细胞在预防以及治疗包括肾脏疾病在内的多种自身免疫性疾病方面具有不可或缺的作用。越来越多的证据支持使用Treg细胞来治疗免疫性疾病和诱导移植物耐受。研究者们正在努力扩大nTreg细胞增强其抑制活性抗原的方式,生成功能稳定的pTreg细胞和iTreg细胞抗原效应,记忆细胞和幼稚Tconv细胞,并制备可以被疾病特异性、移植特异性或炎症特异性方式激活的CAR Treg细胞。这些努力针对减少效应Tconv细胞和记忆Tconv细胞的数量和功能,以期在临床环境中实现长期抗原特异性免疫抑制和稳定的移植物耐受。
要点
1. 自然产生的调节性T细胞(Treg)细胞在维持免疫自我耐受和稳态中发挥作用。
2. Treg细胞利用多种细胞接触依赖和体液因子介导的机制来发挥其免疫抑制功能,特别是通过控制抗原提呈细胞的功能。
3. 与Treg细胞功能相关的基因突变而导致的Treg细胞异常,可导致自身免疫性疾病和炎症性疾病,包括自身免疫性肾脏疾病。
4. Treg细胞可通过抑制参与细胞介导和/或抗体介导的移植排斥反应中的免疫细胞来建立移植耐受。
5. 通过IL-2或小分子药物使天然Treg细胞在体内扩增可能对自身免疫性疾病的治疗有利。
6. 采用Treg细胞治疗,使用体外扩增天然或诱导嵌合抗原受体Treg细胞是治疗自身免疫性疾病和诱导移植物耐受的有前景的方法。
作者:王涵 邬步云
来源:江苏省人民医院肾内科 公众号
( 转载文章系出于传递更多信息之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请通过 邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。)
2023-10-17 15:55:19 13985 浏览
表达转录因子叉头盒蛋白P3(FOXP3)的调节性T(Treg)细胞自然存在于免疫系统中,并在维持免疫自我耐受、免疫系统和组织稳态中发挥作用。Treg细胞通过多种机制抑制T细胞的活化、扩增和载体功能,特别是通过控制抗原提呈细胞的功能来抑制T细胞。它们还可以通过抑制炎症和促进组织再生来促进组织修复。Treg细胞的单基因异常和Treg细胞功能分子的遗传变异可导致或促使患者发展为自身免疫性疾病和其他炎症性疾病,包括肾脏疾病。
Treg细胞可以用于靶向治疗免疫疾病并建立移植耐受,例如,通过使用IL-2或小分子在体内扩增天然Treg细胞,或在体外扩增用于进行Treg细胞治疗。研究者也在努力将抗原特异性的常规T细胞转化为Treg细胞并生成嵌合抗原受体Treg细胞。
来自日本大阪大学的Mikami N和东京大学的Sakaguchi S在这篇综述中描述了对nTreg(tTreg和pTreg)和iTreg细胞发育和功能的细胞和分子基础的理解及进展。基于基础Treg细胞研究的发现,讨论了nTreg细胞发育或功能的分子异常如何导致自身免疫性疾病和其他炎症性疾病的发生,包括自身免疫性肾脏疾病。这篇综述还讨论了如何利用nTreg细胞和iTreg细胞来治疗肾脏疾病和诱导免疫耐受,特别是在肾移植的情况下。
二、调节性T细胞的背景介绍
调节性T(Treg)细胞是一种独特的CD4+ T细胞亚群,自然存在于免疫系统中,进行免疫抑制。这些细胞特异性表达转录因子叉头盒蛋白P3(FOXP3),并表达高亲和力的IL-2受体,CD25以及共抑制受体细胞毒性T淋巴细胞抗原4(CTLA4)作为受体的组成部分。
自然产生的FOXP3+ CD25+ CTLA4+ CD4+ Treg(称为nTreg)细胞对于维持免疫自我耐受和稳态是不可或缺的。在正常啮齿动物中,当CD25+ CD4+ T细胞被移除时,就会发生自身免疫性疾病,如T1DM、自身免疫性甲状腺炎和胃炎;这些疾病可以通过重建CD25+ CD4+ Treg细胞来预防。此外,FOXP3突变会导致人类和啮齿动物的先天性Treg细胞缺陷,从而导致IPEX(免疫缺陷、多内分泌病、肠病、x-连锁)综合征。
鉴于Treg细胞在免疫耐受和稳态中不可或缺的作用,它们可以在临床环境中靶向控制生理和病理免疫反应。例如,在肿瘤宿主中消耗Treg细胞可以唤起和增强抗肿瘤免疫,而Treg细胞扩增在治疗自身免疫性和炎症性疾病以及建立异体器官移植的免疫耐受方面发挥重要作用。
大多数FOXP3+ Treg细胞是由胸腺产生的,作为一个功能独特且成熟的群体。这些胸腺来源的Treg(称为tTreg)细胞功能稳定,并具有广泛的抗原特异性。一些T细胞在周围分化为Treg细胞,特别是在肠黏膜中。这些外周来源的Treg(称为pTreg)细胞也功能稳定,但其抗原特异性有限。常规T细胞也可以在体外诱导Treg细胞。然而,这些诱导的Treg(称为iTreg)细胞功能不稳定,抗原特异性有限。为了治疗,研究者努力在体内和体外扩增nTreg细胞,保留其抑制功能,并产生具有特定抗原特异性的功能稳定的iTreg细胞(图1)。

图1 .FOXP3+ Treg细胞。调节性T细胞(Treg)是一种独特的CD4+ T细胞群体,它可以抑制其他免疫细胞的功能,特别是效应T细胞。除了转录因子FOXP3的表达外,Treg细胞还在其细胞表面构成性表达CD25和CTLA4。
三、Treg细胞的发展和功能
Treg细胞在胸腺内分化为成熟的具有不同功能的抗原特异性抑制T细胞。相比之下,传统T(Tconv)细胞在外周受到抗原刺激并分化为抗原特异性效应T细胞之前,它们在功能上是幼稚的。在胸腺中,发育中的对自肽-mhc配体有中度亲和力的T细胞驱动发育为Treg细胞,而低度亲和力的发育为幼稚Tconv,高亲和力的被去除。因此,tTreg细胞具有与Tconv细胞一样广泛的TCR库,但倾向于识别胸腺自肽-MHC配体,比被相同配体选择的Tconv细胞具有更高的亲和力。
在与自身肽-mhc配体相互作用后,发育中的胸腺Treg(tTreg)细胞中的TCR信号激活Treg特异性增强子,特别是Treg特异性超级增强子(Treg-SEs)(由H3K27组蛋白乙酰化程度定义),这些基因与Treg特征基因如Foxp3、Il2ra和Ctla4相关。Treg-SEs的激活诱导了这些基因的表达,从而决定了tTreg细胞的身份。
1.Treg细胞的稳定性和表观遗传学
天然Treg(nTreg)细胞功能稳定,在各种动物模型中,nTreg细胞的采用过继性转移可以实现长期抑制自身免疫性疾病的发展,而nTreg细胞的消耗可以在生命的任何阶段诱发自身免疫性疾病。tTreg细胞不仅在TCR库中存在自倾斜,而且处于抗原引物状态(通过T细胞辅助分子如粘附分子的高表达得到证明),并具有foxp3依赖的TCR近端信号控制。这些Treg细胞的特性,连同它们的高IL-2敏感性,使它们能够快速和强烈激活,在抗原识别时扩展,确保它们在炎症部位对Tconv细胞的显性抑制。
在生理条件下,一些效应型nTreg细胞处于活跃的增殖状态,可能是因为它们已经识别了自身抗原或可能来自共生微生物的抗原。特别是DNA甲基化和去甲基化,稳定地通过细胞分裂遗传,有助于细胞谱系连续性tTreg细胞从胸腺到外围稳定Treg特异性基因表达,因此使这些细胞维持免疫自我耐受和稳态。nTreg细胞在Treg特征基因位点(如Foxp3、Il2ra和Ctla4)上获得了一种独特的DNA低甲基化模式,而这种模式在幼稚或激活的Tconv细胞或其他免疫细胞中没有发现。
2.周围nTreg细胞的存活需要IL-2
周围nTreg细胞的存活和功能维持需要TCR刺激和IL-2。IL-2的缺乏和高亲和力的IL-2受体表达的独特组合是Treg细胞的一个基本特征。FOXP3在TCR刺激下抑制IL-2的转录,而IL2RA基因位点的Treg-SE有助于高亲和力IL-2受体的特异性表达,该受体与外源性IL-2结合。因此,Treg细胞的生存高度依赖于外源IL-2。短期给予抗IL-2中和性单克隆抗体(mAb)可显著减少Treg细胞的数量,抑制其在识别自身抗原时的增殖,从而导致自身免疫性疾病的发展。
3.Treg细胞在维持组织稳态中的作用
在生理条件下,效应型Treg细胞迁移并驻留在器官和组织中,如皮肤、肺、肠和脂肪组织,以积极维持局部组织稳态。这些Treg细胞具有组织特异性的表型,表达特定的趋化因子受体。CCR4的缺乏会阻止Treg细胞在皮肤和肺中的生理积累,从而导致这些器官的炎症。
此外,Treg细胞和效应Tconv细胞被招募到炎症的特定组织部位,表现出类似的转录因子和趋化因子受体表达模式。例如,Treg细胞1型炎症表达T-bet和CXCR3,2型炎症表达GATA3,CCR4和/或CCR8,和3型炎症表达CCR6 RORγt,这分别与T辅助1(TH1)细胞,T辅助2(TH2)细胞和T辅助17(TH17)细胞一样。Treg细胞不仅通过抑制炎症,还通过积极促进进组织再生,例如,通过产生生长因子双向调节蛋白。
综上所述,Treg细胞通过抑制炎症和促进组织干细胞的分化和增殖来调节局部组织环境,从而发挥作用。
4.Treg细胞的抑制功能
FOXP3+ Treg细胞通过细胞接触依赖和体液因子介导的机制,包括细胞表面分子(CTLA4、CD25、TIGIT、CD39和CD73)、细胞因子(IL-2、IL-10、TGFβ和IL-35),以及分泌的或细胞内的分子(颗粒酶、cAMP和IDO)。FOXP3的异位表达可以抑制Tconv细胞活性,这表明FOXP3作为一些基因的抑制因子,或作为其他基因的激活因子,控制着Treg签名分子(s)介导的Treg细胞介导的抑制的表达。敲除Il2、Il2ra或Il2rb的小鼠会发生类似于FOXP3突变体或缺陷小鼠的致命的自身免疫性疾病,可能是由于Treg细胞存活率降低。
CTeg细胞特异性缺乏CTLA4会产生严重的自身免疫性疾病,而Treg细胞特异性IL-10缺乏会引起结肠炎和肺炎,但不会引起自身免疫性疾病。
Treg细胞特异性缺陷导致自身免疫性疾病。比如FOXP3缺陷,该分子具有Treg细胞特异性基因调控,确保其在Treg细胞中高/持续表达,抑制Treg细胞耗尽产生的自身免疫性疾病。在Treg细胞激活剂上共刺激信号,比效应Tconv细胞的功能更强。抗原激活的Treg细胞与抗原呈递细胞(APC)在有限时间内相互作用,通过决定应答T细胞的细胞命运(凋亡细胞死亡、无反应性或休眠),实现长期的免疫抑制和耐受(图2)。
CTLA4依赖的APCs抑制是Treg细胞介导的免疫抑制的潜在核心机制;然而,上面讨论的其他分子和机制可以根据组织位置、炎症类型和强度在不同程度上增强Treg细胞介导的免疫抑制。

图2 | Treg细胞介导的免疫抑制和诱导长期耐受。调节性T(Treg)细胞组成性表达CTLA4和CD25,并在T细胞受体(TCR)刺激下上调这些受体的表达(步骤1)。TCR刺激激活后,Treg细胞通过CTLA4依赖的滋养细胞作用和随后的反内吞作用下调抗原提呈细胞(APCs)上CD80和CD86的表达,从而降低了应答T细胞的共刺激分子的可用性(步骤2)。这种自由的PD-L1可以与表达PD1的效应T细胞相互作用,抑制它们的激活和效应功能(步骤3)。Treg细胞也表达高亲和力的IL-2受体,并从周围环境中吸收IL-2,从而剥夺应答T细胞的IL-2,并可能有助于抑制它们。
5.人Treg细胞亚群
人循环中的FOXP3+ T细胞可以高度富集为CD127(也称为IL-7受体亚基-α)阴性的CD4+ T细胞。然而,一些活化的CD127lowCD4+ Tconv细胞也表达FOXP3,尽管其表达水平较低,体外抑制活也更低。健康个体循环的FOXP3+ CD4+ T细胞根据其FOXP3和CD45RA的表达可分为三个部分。组分I(FrI)CD45RA+FOXP3lowCD25低幼稚或静息调节T(Treg)细胞包括最近的胸腺迁移,并在TCR刺激下分化为组分II(FrII)CD45RA?FOXP3hiCD25hi效应Treg细胞。Fr II细胞表达高水平的CTLA4,具有高度增殖性和强抑制性,并具有Treg细胞型表观基因组。相比之下,大多数组分III(FrIII)CD45RA?FOXP3lowCD25低T细胞没有抑制作用。这部分主要包括活化的常规T(Tconv)细胞,包括各种辅助T细胞亚群,FOXP3表达不稳定。总之,人体FOXP3阳性的T细胞在功能、基因型和分化阶段上存在异质性,包括幼稚Treg细胞、效应Treg细胞和活化的Tconv细胞。这些亚型的改变可以反映免疫疾病的存在。

图3人FOXP3+ T细胞的亚群。
四、自身免疫性和炎症性疾病
中的Treg性细胞
1. 调节T细胞病
影响Treg细胞的单基因自身免疫性疾病或炎症性疾病被称为调节T细胞病(tregopathies)。IPEX综合征于1982年首次被描述为一种x-连锁免疫缺陷综合征,并伴有严重的自身免疫性疾病、T1DM、肠病和湿疹。除了这一典型的新生儿发病三联征外,IPEX综合征患者还会发生不同频率的自身免疫性疾病(如自身免疫性甲状腺炎、肾炎、关节炎、肝炎、溶血性贫血、血小板减少和脱发)。2000-2001年发表的研究确定了该疾病基因为FOXP3。迄今为止,在IPEX综合征患者中至少报道了70个FOXP3基因突变。这些突变取消了功能性FOXP3蛋白的表达,导致严重的临床表现。IPEX综合征提供了明确的证据,表明nTreg细胞的缺陷或功能障碍不仅可能是人类自身免疫性疾病的主要原因,也可能是人类炎症性肠病(IBD)和过敏的主要原因。这一综合征表明,人类Treg细胞在抑制对自身和非自身抗原的免疫反应方面发挥了作用。
其他和Treg细胞功能相关基因的突变也可导致严重的自身免疫疾病。比如编码CD25、CTLA4的IL2RA基因突变可发展为严重自身免疫疾病。可促进Treg细胞分化和Treg/Th17细胞平衡的BACH2和STAT3基因突变可导致肠病和其他免疫异常。DiGeorge(22q11.2缺失)综合征和Omenn综合征伴有严重的联合免疫缺陷和自身免疫也经常与胸腺和循环Treg细胞的减少有关。编码自身免疫调节因子(AIRE)的AIRE基因功能缺失突变导致自身免疫性多内分泌腺病-念珠菌病-外胚层营养不良(APECED)综合征,循环中幼稚Treg细胞数量减少。
2.多因素多基因自身免疫性疾病
全球有5~10%的人口都受到常见的多因素多基因自身免疫性疾病如T1DM,类风湿关节炎和系统性红斑狼疮的影响。器官特异性自身免疫性疾病患者中,组织炎症部分的FOXP3阳性T细胞数量增加,但外周血中的数量并不会改变。与免疫学方法相比,基因组分析可以为Treg细胞在自身免疫中的作用提供更可靠的线索。
全基因组关联研究(GWAS)发现,在常见的多基因自身免疫性疾病中,约有60%的因果单核苷酸多态性(SNPs)定位于免疫细胞的非编码增强子区域,特别是CD4+ T细胞。这表明与T细胞功能相关基因相关的自身免疫SNPs主要是影响Treg细胞的功能丧失变异,而不是影响自身免疫Tconv细胞的功能获得变异。许多自身免疫易感SNPs存在于Treg细胞功能相关基因的增强子区域,如IL2RA和CTLA4,可能作为控制内源性Treg细胞发育和功能的表达数量性状位点。
3.自身免疫性肾病
约30%的IPEX患者发展为自身免疫性肾脏疾病,如肾小球肾炎和膜性肾病,提示Treg细胞异常可能是这些疾病的主要原因。一些Treg细胞异常性疾病,如IPEX综合征,也显示肾脏中有炎症细胞浸润。通过全基因组关联研究(GWAS)发现的与Treg细胞发育和功能有关的自身免疫性单核苷酸多态性(SNPs)可能是系统性红斑狼疮(SLE)和IgA肾病的致病变异。许多报道也介绍了肾脏疾病患者循环Treg细胞数量的变化,但其病理性意义尚不清楚。
一项关于活动性SLE患者的研究报告称,Fr II效应Treg细胞的比例显着降低,而Fr I幼稚Treg细胞和特别是Fr III非Treg细胞的比例显着增加,与健康个体相比,这些结果表明激活的FOXP3+ T conv细胞(分泌促炎细胞因子)的数量增加。该研究中未报告狼疮肾炎患者的比例。然而约38%的SLE患者合并肾脏疾病。
Goodpasture病是由针对IV型胶原的CD4+ T细胞介导的,该T细胞攻击肾小球基底膜(GBM)。识别IV型胶原肽-MHC的Treg细胞在HLA-DR1等位基因起主要保护作用的人群以及同时表达保护性HLA-DR1和易感HLA-DR15等位基因的人群中显着增加。因此,HLA基因多态性在一定程度上通过影响自身抗原特异性Treg细胞的数量和谱系来参与疾病易感性的形成。
在老鼠中,CD25+CD4+ nTreg细胞的耗竭导致了各种自身免疫性疾病的发展。其中一些老鼠发展为肾小球肾炎,伴有免疫复合物沉积在肾小球毛细血管丛中。这种肾脏病变类似于狼疮肾炎,并且这些老鼠具有高滴度的IgG抗dsDNA和其他狼疮自身抗体。另一项研究发现,叶酸受体4(FR4)由nTreg细胞特别是活化的nTreg细胞特异性表达。给予抗FR4 mAb可使年轻老鼠的这些细胞耗竭,并导致器官特异性自身免疫性疾病的发展,包括严重的自身免疫性膀胱炎和输尿管炎,这些疾病伴有针对尿路上皮细胞的自身抗体,最终导致由于输尿管梗阻而引起的肾积水。
CD25+CD4+ nTreg细胞已被证明在各种模型中可以防止自身免疫性肾脏疾病的发展,包括狼疮易感的NZBxNZW F1小鼠的肾小球肾炎、由 pristane 诱导的狼疮肾炎、由抗GBM抗体诱导的肾小球肾炎、髓过氧化物酶抗中性粒细胞胞质抗体(MPO-ANCA)相关的肾小球肾炎以及由长期给予BSA和CCl4引起的大鼠的IgA肾病。Treg细胞的保护作用也已在急性肾损伤(AKI)的啮齿动物模型中得到证实,例如缺血再灌注损伤、顺铂肾毒性和败血症诱导的AKI,以及包括阿霉素肾病在内的慢性肾病模型中得到证实。此外,nTreg细胞的过继转移可以防止db/db小鼠模型中糖尿病肾病的发展。
在一些自身免疫性肾脏疾病中,如Goodpasture病和狼疮性肾炎,调节性T细胞似乎抑制TFH细胞和B细胞。在蛋白免疫接种的小鼠和自身抗体介导的关节炎模型(K/BxN小鼠)中,调节性T细胞的耗竭增加了TFH细胞和浆细胞的数量、生发中心的形成和抗体的产生。阻断CTLA4或特异性的调节性T细胞CTLA4基因敲除,导致生发中心对蛋白免疫接种的反应增强,伴TFH细胞、TFR细胞和浆细胞增多。在SLE患者中,TFH细胞的增加与自身抗体滴度和肾脏损伤程度相关,而TFR细胞与TFH细胞的比例与疾病活动性相关。这些研究表明,调节性T细胞(尤其是TFR细胞)是抑制抗体介导的自身免疫性肾脏所必需的。
现有数据表明,nTreg细胞的异常可能导致一些自身免疫性肾脏疾病,尽管免疫复合物性肾小球肾炎可能是由Treg细胞异常引发的系统性自身免疫反应所继发的。调节性T细胞也可以用于治疗动物模型中的自身免疫性肾脏疾病,通过直接抑制肾脏炎症或间接抑制系统性自身免疫炎症。
五、器官移植中的Treg细胞
FOXP3+ Treg细胞可以抑制参与移植排斥的免疫细胞,包括CD8+细胞毒性T细胞、TH1细胞、TH2细胞和TH17细胞,有助于细胞介导的移植排斥;TFH细胞和B细胞产生供体特异性抗体;树突状细胞和B细胞,通过直接和间接途径向T细胞呈现异体抗原。Treg细胞也能在实体器官移植中建立移植物耐受性,预防实验动物造血干细胞移植后的移植物抗宿主病(GVHD)。
1.移植耐受
CD25+CD4+nT-reg细胞在移植耐受中的作用首先是通过发现CD25+CCD4+nTreg细胞的耗竭不仅引起小鼠的自身免疫,而且加速小鼠的皮肤移植物排斥反应而提出的。随后在具有同种异体皮肤移植物的T细胞缺陷小鼠中的实验表明,在高Treg与Tconv细胞比率下,nT-reg细胞与Tconv细胞的共转移可以实现稳定的移植物耐受性;从已建立耐受性的小鼠过继转移Treg细胞可以将这种耐受性过继转移到正常小鼠;并且经过体外同种异体抗原刺激以诱导具有同种异体抗原特异性的那些细胞扩增的nTreg细胞比未刺激的nTreg细胞具有更有效的耐受诱导活性。类似地,来自具有移植物耐受性的小鼠的nTreg细胞,例如,通过用环孢素或细胞非消耗性抗CD4 mAb处理诱导的,可以过继转移这种耐受性。
在异基因混合淋巴细胞反应测定中,nTreg细胞以抗原特异性和剂量依赖性的方式抑制应答T细胞。此外,在高剂量IL-2存在下用同种抗原刺激的nTreg细胞显示出克隆扩增,并且在体内和体外表现出比未刺激的Treg细胞更强的同种抗原特异性抑制。这些发现表明,耐受诱导的功效取决于同种抗原特异性nTreg细胞的扩增及其对同种反应效应物Tconv细胞的显性抑制。
2.肾移植
一项在肾和骨髓联合移植(CKBMTs)受者中的研究表明了Treg细胞在人肾移植耐受中的作用,该研究显示在稳定耐受状态的异体肾移植中FOXP3 mRNA高水平表达。患者的TCR报告分析显示,肾移植耐受可归因于同种异体T细胞的缺失和供体特异性Treg细胞的富集。因此,Treg细胞特别是激活的效应型Treg细胞的扩增,可能是肾移植中稳定耐受的重要生物标志物。
六、Treg细胞疗法
FOXP3+ Treg细胞有可能作为抗原特异性的“活药物”,用于治疗自身免疫性疾病并诱导移植耐受(图4)。使用Treg细胞疗法可以规避与目前非抗原特异性免疫抑制疗法(如皮质类固醇、钙调神经磷酸酶抑制剂、抗t细胞血清和CTLA4-Ig相关的各种临床问题,包括由于长期使用而增加感染的可能性和药物毒性。

图4.在自身免疫性疾病或移植中建立Treg细胞介导的显性耐受的潜在方法。a,通过低剂量IL-2、抗胸腺细胞球蛋白(ATG)或雷帕霉素的治疗,自然调节性T(nTreg)细胞可以在体内以抗原特异性或非特异性(多克隆)的方式扩增。b,nTreg细胞也可以通过抗原和IL-2刺激在体外扩增,然后作为采用Treg细胞治疗。c,嵌合抗原受体(CAR)Treg细胞也可以通过工程CARs的转导由nTreg细胞产生,并用作采用的Treg细胞治疗。标准的CAR结构可以识别单个分子,而nTreg细胞可以通过它们的TCR识别广泛的抗原。d,常规T(Tconv)细胞也可以在体内转化为外周来源的Treg(pTreg)细胞,例如通过CDK8/19。e,体外诱导Tconv细胞转变为Treg(iTreg)细胞。这些方法可能会建立一种显性耐受状态,在这种状态下,Treg细胞能够抑制介导自身免疫性疾病或移植物排斥反应的效应T(Teff)细胞的功能。
1.体内nTreg细胞扩增
临床应用Treg细胞的方法主要是扩增生成功能性FOXP3+ nTreg细胞,并增强其抑制功能,特别是通过IL-2扩大Treg细胞和抑制TH17和TFH细胞的分化。低剂量的IL-2可以选择性地扩大Treg细胞,同时避免Tconv细胞的激活扩增和高剂量IL-2的严重副作用,因为Treg细胞构成表达高水平的高亲和力的IL-2受体,不产生IL-2和内在激活STAT5依赖信号通路。
低剂量IL-2也能诱导Treg细胞中抗凋亡的BCL-2的表达,并增强其在人体内的抑制功能。低剂量IL-2诱导Treg细胞扩增首次被证明有利于治疗丙型肝炎病毒诱导的血管炎和GVHD,随后被研究用于其他免疫性疾病的治疗,包括SLE和T1DM。
小分子也可以不同地控制Treg细胞和Tconv细胞,从而促进耐受性诱导。例如,TCR信号通过PI3K-AKT-mTOR通路调节nTreg细胞的发育,mTOR抑制剂雷帕霉素已被证明在体内和体外扩增nTreg细胞。该药物有可能在临床环境中用于扩增nTreg细胞。与接受钙调神经磷酸素抑制剂治疗的肾移植受者相比,接受雷帕霉素免疫抑制方案治疗的Treg细胞数量增加。在小鼠中,口服周期蛋白依赖性激酶8(CDK8)和CDK19的化学抑制剂,与中介复合物相关并调节基因转录,诱导抗刺激Tconv细胞中Foxp3的表达,将其转化为具有Treg型表观基因组的pTreg细胞,包括Foxp3 CNS2去甲基化。因此,靶向Foxp3诱导所需的细胞信号传递的小分子可能被用作新的免疫抑制疗法。
2. nTreg细胞疗法
另一种治疗自身免疫性疾病和预防移植物排斥反应的方法是采用Treg细胞治疗。目前大多数Treg细胞疗法是从患者的血液中纯化得到Treg细胞,然后通过抗cd3/CD28刺激在体外扩增,从而产生多克隆的Treg细胞群,或通过异基因刺激细胞的刺激,得到丰富的同种异体抗原特异性Treg细胞。自体nTreg细胞治疗的I期临床试验表明,该方法对T1DM患者和GVHD患者是安全的。转移的Treg细胞在转移1年后仍能在循环中检测到。在肾移植中,nTreg细胞治疗方法的应用也已在各种Treg细胞扩增方法的临床试验中进行了研究(表1)。
图片
表1 肾移植中Treg细胞疗法的临床试验
I期TRACT试验(NCT02145325)报道,在2年的随访中,体外输注多克隆扩增的自体Treg细胞增加了肾移植受者的循环Treg细胞水平,而没有任何不良事件,如排斥或感染。扩增的Treg细胞显示FOXP3 CNS2高度去甲基化。一项I/IIa期临床试验(NCT02371434)显示,在60周的研究期间,肾移植后7天输注多克隆扩增的自体nTreg细胞可使免疫抑制最小化;在接受Treg细胞治疗的患者中实现了单药免疫抑制,而参照组患者仍接受双重或三重免疫抑制治疗。在这项研究中,通过TCR序列分析证实了移植物特异性Treg细胞的扩增。另一项I期试验(NCT02129881)报道,与移植后48个月接受标准免疫抑制的患者相比,接受自体多克隆nTreg细胞注射的肾移植受者无排斥,生存得到改善。两项临床研究(NCT02244801和NCT02091232)已经研究了供体特异性nTreg细胞在肾移植中的应用。
开发更有效的nTreg细胞治疗方法的关键挑战是提高Treg细胞的纯度、抗原特异性、功能稳定性和存活率,特别是在体内转移后。虽然效应nTreg细胞在体内处于高度增殖状态,但体外TCR刺激主要使幼稚的nTreg细胞扩张,导致激活和促凋亡表型。这些被激活和扩张的Treg细胞中有相当一部分可能在转移后立即死亡,因为它们从体外高IL-2浓度环境转移到体内低IL-2环境。因此,IL-2给药可能有助于增加Treg细胞转移后的存活,而不将其转化为Tconv细胞。
3. iTreg细胞治疗
使用iTreg细胞的优势是CD4+ Tconv细胞通过体外抗原刺激TGFβ和IL-2容易制备大量的抗原iTreg细胞。然而,使用iTreg细胞的一个缺点是其功能不稳定。与nTreg细胞相比,iTreg细胞中Foxp3的表达是不稳定的,主要是由于Treg-DRs的不完全表观遗传变化,导致它们在某些体内条件下重新转化为效应T细胞。
通过安装nTreg型表观遗传变化,各种方法可以增加iTreg的稳定性。抗坏血酸(也被称为维生素C)作为10-11种易位(TET)酶的辅助因子,介导DNA去甲基化。在GVHD186-188小鼠模型中,抗坏血酸已被证明可以促进Foxp3 CNS2在小鼠iTreg细胞中的从头低甲基化,从而提高Foxp3表达的稳定性和这些细胞的抑制活性。据报道,一些小分子可以诱导Foxp3,包括雷帕霉素、维甲酸和丁酸,但它们都需要TGFβ在体外诱导Foxp3,在炎症条件下作用有限。
然而,使用这些方法结合剥夺CD28共刺激可能可以利用CRISPR-cas9介导的基因缺失进行基因组编辑,也可能被用于修饰对iTreg细胞生成和功能有利或不利的分子的表达。在未来,进一步的技术进步有望使抗原特异性iTreg细胞用于与nTreg细胞具有类似功能和稳定性的细胞治疗。
4. CAR Treg细胞疗法
在nTreg细胞或iTreg细胞中,通过转导工程TCR或嵌合抗原受体(CAR)可以有效地产生抗原特异性Treg细胞。CARs是由抗体的抗原结合区、TCR的胞内结构域和刺激分子如CD3、CD28和4-1BB(也称为TNFRSF9和CD137)组成的人工受体。在小鼠模型中,异性TCR转导或CAR转导的nTreg细胞在延长皮肤移植存活和抑制GVHD方面比对照nTreg细胞更有效。
一项首次在人的I/IIa期临床研究已经开始评估HLA-A2特异性CAR Treg细胞治疗活体供肾移植受者的安全性和耐受性。与nTreg细胞相比,使用CAR Treg细胞的一个优点是,前者可以通过在任何nTreg细胞中表达单一的CAR结构,具有MHC不受限制的生理TCR依赖抗原识别。然而,CAR结构中的抗体Fab部分将靶分子的识别限制在主要表达在靶细胞表面或炎症环境中的单个分子上,而nTreg细胞的TCR可以识别APCs呈递的任何抗原。目前正在努力识别被CAR识别的靶分子,以特异性激活CAR Treg细胞进行炎症特异性免疫抑制,并使用第三方Treg细胞或多能干细胞来源的Treg细胞制备“现成的”Treg细胞疗法。这些方法不仅可以提高治疗效果,而且还可以降低治疗的成本。
七、总结
nTreg细胞在预防以及治疗包括肾脏疾病在内的多种自身免疫性疾病方面具有不可或缺的作用。越来越多的证据支持使用Treg细胞来治疗免疫性疾病和诱导移植物耐受。研究者们正在努力扩大nTreg细胞增强其抑制活性抗原的方式,生成功能稳定的pTreg细胞和iTreg细胞抗原效应,记忆细胞和幼稚Tconv细胞,并制备可以被疾病特异性、移植特异性或炎症特异性方式激活的CAR Treg细胞。这些努力针对减少效应Tconv细胞和记忆Tconv细胞的数量和功能,以期在临床环境中实现长期抗原特异性免疫抑制和稳定的移植物耐受。
要点
1. 自然产生的调节性T细胞(Treg)细胞在维持免疫自我耐受和稳态中发挥作用。
2. Treg细胞利用多种细胞接触依赖和体液因子介导的机制来发挥其免疫抑制功能,特别是通过控制抗原提呈细胞的功能。
3. 与Treg细胞功能相关的基因突变而导致的Treg细胞异常,可导致自身免疫性疾病和炎症性疾病,包括自身免疫性肾脏疾病。
4. Treg细胞可通过抑制参与细胞介导和/或抗体介导的移植排斥反应中的免疫细胞来建立移植耐受。
5. 通过IL-2或小分子药物使天然Treg细胞在体内扩增可能对自身免疫性疾病的治疗有利。
6. 采用Treg细胞治疗,使用体外扩增天然或诱导嵌合抗原受体Treg细胞是治疗自身免疫性疾病和诱导移植物耐受的有前景的方法。
作者:王涵 邬步云
来源:江苏省人民医院肾内科 公众号
( 转载文章系出于传递更多信息之目的,且明确注明来源和作者,如果您认为我们的转载侵犯了您的权益,请通过 邮箱(zlzs@120.net)通知我们,我们将第一时间处理,感谢。)

 抢沙发,发首评,稳占C位!
立即抢沙发
抢沙发,发首评,稳占C位!
立即抢沙发




